Перегрузочная форма сердечной недостаточности причины механизмы развития
Миокардиальная форма сердечной недостаточности
МИОКАРДИАЛЬНАЯ ФОРМА СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ.
Прямые повреждения миокарда могут быть вызваны инфекцией, интоксикацией, гипоксией, авитоминозом, нарушением венечного кровообращения и др. факторами. При этом нарушается образование макроэргов в кардиомиоцитах или использование их энергии. Это приводит к понижению сократительной способности сердца, а следовательно – к понижению ударного и минутного объема сердца, что влечет за собой повышение КДО (конечного диастолического объема ) и КДД (конечного диастолического давления) в желудочках сердца, а затем и повышение венозного давления.
Таким образом, всякая СН ведет к понижению МОС и повышению ВД. Это два главных признака и последствия сердечной недостаточности
На внутрисердечные механизмы компенсации накладываются и внесердечны е, они также направлены на восстановление МОС. Итак, недостаточность кровообращения сердечного типа начинается с уменьшения МОС, что влечет за собой понижение давления крови в аорте – это улавливается барорецепторами дуги аорты и синокаротидной зоны и происходит снижение импульсации с барорецепторов, это приводит к повышению тонуса симпатических нервов и определяет полноту клинических проявлений СН (тахикардия, одышка, отеки, цианоз). В результате возбуждения симпатической н.с. увеличивается частота и сила сердечных сокращений. Это определяет существенный признак СН — развитие тахикардии. Кроме того, под влиянием симпатических импульсов происходит сокращение вен, которые в норме содержат до 50 % всей циркулирующей крови. Это приводит к повышению венозного давления, увеличению венозного возврата.
Основные механизмы развития миокардиальной недостаточности
СН вызывается главным образом двумя группами причин:
-
оказывающими прямое повреждающее действие на миокард, обусловливающими функциональную перегрузку сердца.
Многочисленные факторы 1-й группы причин СН можно условно разделить на 3 подгруппы в зависимости от их природы:
-
физического характера — травма миокарда, сдавление сердца экссудатом, опухолью, действие электрического тока, лучистой энергии и т. п.; химического (в том числе биохимического) характера — высокие концентрации биологически активных веществ: адреналина, тироксина, ангиотензина; большие дозы лекарственных и нелекарственных веществ — разобщителей процесса окислительного фосфорилирования, блокаторов транспорта ионов кальция, ингибиторов транспорта электронов в цепи дыхательных ферментов митохондрий и т. п.; биологического происхождения — токсины, микробы, паразиты, вирусы.
К этой же группе причин СН следует отнести также недостаток (или отсутствие) в организме факторов, необходимых для адекватного функционирования сердца: витаминов, субстратов метаболизма, кислорода, ферментов, соединений, обладающих антиоксидантной активностью. Наиболее часто такая ситуация является следствием коронарной недостаточности.
Факторами, вызывающими СН вследствие перегрузки миокарда, могут быть:
-
чрезмерное увеличение количества притекающей к сердцу крови (увеличение «преднагрузки»); значительное повышение сопротивления, которое оказывается при ее изгнании из сердечных полостей в аорту и легочную артерию (увеличение «постнагрузки»); изменения в различных органах и системах: в самом сердце (пороки клапанов, уменьшение массы сократительного миокарда в результате его ишемии, инфаркта или кардиосклероза), в сосудистом русле (артериальная гипертензия. артериовенозное шунтирование), в системе крови (гиперволемия, полицитемия); нейрогуморальная дисрегуляция сердечной деятельности (чрезмерная активация симпатергических влияний на миокард, тиреотоксикоз и т. п.).
Как правило, СН является результатом действия патогенных факторов обеих групп — повреждающих миокард и вызывающих его перегрузку. Однако даже с учетом этого условия в развитии СН всегда можно определить ведущий механизм.
В связи с этим большинство современных исследователей [Meерсон Ф. З. 1965; Мухарлямов Н. М. 1978; Fledkenstein A. etal. 1967] выделяют два основных патофизиологических варианта СН:
-
в результате повреждения миокарда («миокардиальная» форма); вследствие функциональной перегрузки сердца («перегрузочная» форма).
В большинстве случаев СН развивается в результате сочетания прямого повреждения миокарда и его перегрузки — смешанная форма СН.
Помимо этих форм (их условно можно назвать первичными, или «кардиогенными»), встречаются также такие, которые обусловлены преимущественно первичным уменьшением притока крови к сердцу при нормальной его сократимости. Они могут быть результатом значительного снижения массы циркулирующей крови, нарушения диастолического расслабления сердца при его сдавлении жидкостью, накапливающейся в полости перикарда (экссудат, кровь), и других подобных состояний. Эти разновидности СН обозначают как вторичные, или «некардиогенные».
В условиях коронарной недостаточности в эксперименте или при ХИБС в клинике сердечная недостаточность нередко возникает при повреждении сердца вследствие его транзиторной ишемии, поскольку всякий приступ стенокардии приводит к преходящему снижению сократимости миокарда, а частые и постоянные приступы стенокардии закрепляют этот эффект [Комаров Ф. И. Ольбинская Л. И. 1978].
Таким образом, независимо от «пускового» механизма сердечной недостаточности (приступы стенокардии, очаговые изменения миокарда после острых инфарктов) развитие ее, степень выраженности, помимо других факторов (характер труда, образ жизни, сопутствующие заболевания и пр.), в значительной мере зависят от состояния коронарного кровообращения. В связи с этим оптимизация коронарного кровотока является одним из важных факторов в комплексе лечебных мероприятий сердечной недостаточности.
«Коронарная и миокардиальная недостаточность»,
Механизмы экстренной компенсации сократительной функции сердца
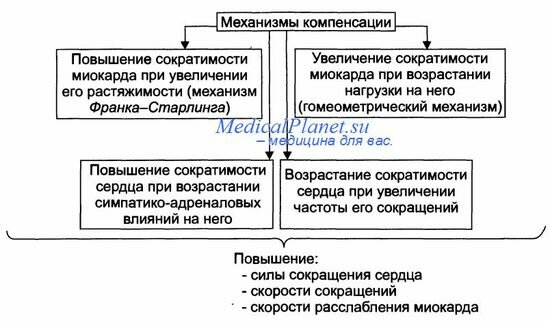
Механизмы экстренной компенсации сниженной сократительной функции сердца приведены на рисунке.
• Повышение сократимости миокарда при его растяжении притекающей кровью (механизм Франка-Старлинга). Обеспечивает увеличение развиваемого миокардом напряжения и скорости сокращения и расслабления.
— Увеличение напряжения. развиваемого сердцем, осуществляется в ответ на нарастающее растяжение миокарда. В связи с этим механизм Франка-Старлинга называют гетерометрическим, т.е. связанным с возрастанием длины мышечного волокна.
— Увеличение скорости сокращения и расслабления кардиомиоцитов развивается в связи с более быстрым выбросом Са 2+ из кальциевых депо (саркоплазматическая сеть) и последующим ускоренным закачиванием Са2+ (Са2+-АТФазы) в цистерны саркоплазматической сети.
 Экстренные механизмы компенсации сниженной сократительной функции сердца
Экстренные механизмы компенсации сниженной сократительной функции сердца
Увеличение силы сокращений миокарда в ответ на повышенную нагрузку. Происходит при неизменной длине миоцитов. Такой механизм называют гомеометрическим, поскольку он реализуется без значительного изменения длины мышечных волокон.
Возрастание сократимости сердца при увеличении ЧСС.
Повышение сократимости сердца в результате возрастания симпатико-адреналовых влияний. Характеризуется увеличением частоты и силы сокращений.
— Симпатическая иннервация миокарда осуществляется окончаниями аксонов адренергических нейронов шейного верхнего, шейного среднего и звёздчатого (шейно-грудного) ганглиев.
— Активация симпатических нервов вызывает положительный инотропный эффект. Увеличивается частота спонтанной деполяризации мембран водителей ритма, облегчается проведение импульса в волокнах Пуркинье, увеличиваются частота и сила сокращения типичных кардиомиоцитов.
— Действие катехоламинов на кардиомиоциты через бета1-адренорецепторы обусловлено рядом последующих событий: стимуляция бета-адренорецептора адреномиметиком (например, норадреналином) -> через G-белок активируется аденилатциклаза с образованием цАМФ -> активация цАМФ-зави-симой протеинкиназы -> фосфорилирование белка р27 сарколеммы -> в саркоплазму увеличивается вход кальция через открытые потенциалозави-симые Са2+-каналы -> усиливается кальций-индуцированная мобилизация Са2+ в цитозоль через активированные рецепторы рианодина -> в саркоплазме значительно повышается концентрация Са2+ -> связывание Са2+ с тропонином С снимает ингибирующее действие тропомиозина на взаимодействие актина с миозином -> образуется большее количество актомио-зиновых связей -> увеличивается сила сокращения.
Компенсаторная гиперфункция сердца
Функционирование названных выше механизмов обеспечивает экстренную компенсацию сократительной функции перегруженного или повреждённого миокарда. Это сопровождается значительным и более или менее длительным увеличением интенсивности функционирования сердца — его компенсаторной гиперфункцией.
Компенсаторная гипертрофия сердца
Гиперфункция миокарда обусловливает экспрессию отдельных генов кардиомиоцитов. Она проявляется увеличением интенсивности синтеза нуклеиновых кислот и белков. Ускорение синтеза нуклеиновых кислот и белков миокарда приводит к нарастанию его массы — гипертрофии. Биологическое значение компенсаторной гипертрофии сердца заключается в том, что увеличенная функция органа выполняется его возросшей массой.
Использованные источники:
Причины и механизмы развития миокардиальной формы сердечной недостаточности
Миокардиальная форма сердечной недостаточности развивается при непосредственном поражении миокарда, когда из функционирования выбывает участок сердечной мышцы (как, например, при инфаркте миокарда) или снижается сократительная функция миокарда в целом (как, например, при миокардитах, кардиомиопатиях, тотальном коронарокардиосклерозе).
Причины: инфекции, интоксикации,гиповитаминозы, коронарная недостаточность, аутоаллергические процессы.
Данная форма связана с нарушением энергетического обмена сердечной мышцы.
Миокардиальная сердечная недостаточность приводит к нарушению , как систолы(сокращения), так и диастолы (расслабления) сердца.
1)Нарушение обменных процессов
2)снижение образования энергии
3) снижение сократительной способности
4)снижение работы сердца
5)развивается в условиях гипофункции сердца
• Нарушение энергетического обмена в миокарде могут быть результатом недостаточности окисления, развития гипоксии, снижения активности ферментов, участвующих в окислении субстратов, и разобщение окисления и фосфорилирования
• Недостаточность субстратов для окисления чаще всего возникает вследствие уменьшения кровоснабжения сердца изменения состава притекающей к сердцу крови, а также нарушения проницаемости клеточных мембран.
• Склероз коронарных сосудов является наиболее частой причиной уменьшения кровоснабжения сердечной мышцы. Относительная ишемия сердца может быть результатом гипертрофии, при которой увеличение объёма мышечных волокон не сопровождается соответствующим увеличением числа кровеносных капилляров
• Метаболизм миокарда может быть нарушен как при недостатке(напр., гипогликемия), так и при избытке(напр.,при резком увеличении в притекающей крови молочной, пировиноградной кислот, кетоновых тел) некоторых субстратов. Вследствие сдвига рН миокарда возникают вторичные изменения активности ферментных систем, приводящие к нарушениям метаболизма
2. Патогенез диффузной дыхательной недостаточности.
Механизмы развития гипоксемии при дыхательной недостаточности
1. Альвеолярная гиповентиляция. Давление кислорода в альвеолярном воздухе меньше атмосферного в среднем на 1/3, что обусловлено поглощением О2 кровью и восстановлением его напряжения в результате вентиляции легких. Это равновесие динамическое. При уменьшении вентиляции легких преобладает процесс поглощения кислорода, а вымывание углекислого газа снижается. В результате развиваются гипоксемия и гиперкапния, что может иметь место при различных формах патологии — при обструктивных и рестриктивных нарушениях вентиляции легких, нарушениях регуляции дыхания, поражении дыхательной мускулатуры.
2. Неполная диффузия кислорода из альвеол. Причины нарушения диффузионной способности легких рассмотрены выше (см. раздел 16.1.2).
3. Увеличение скорости потока крови по легочным капиллярам.
Оно приводит к уменьшению времени контакта крови с альвеолярным воздухом, что отмечается при рестриктивных нарушениях вентиляции легких, когда уменьшается емкость сосудистого русла. Это характерно и для хронической обструктивной эмфиземы легких, при которой тоже имеет место уменьшение сосудистого русла.
4. Шунты. В нормальных условиях около 5% потока крови идет мимо альвеолярных капилляров, и неоксигенированная кровь снижает среднее напряжение кислорода в венозном русле малого круга кровообращения. Насыщение артериальной крови кислородом составляет 96-98%. Шунтирование крови может увеличиваться при повышении давления в системе легочной артерии, возникающем при недостаточности левых отделов сердца, хронической обструктивной патологии легких, патологии печени. Шунтирование венозной крови в легочные вены может осуществляться из системы вен пищевода при портальной гипертензии через так называемые портопульмональные анастомозы. Особенностью ги-
поксемии, связанной с шунтированием крови, является отсутствие лечебного эффекта от вдыхания чистого кислорода.
5. Вентиляционно-перфузионные расстройства. Неравномерность вентиляционно-перфузионных отношений свойственна нормальным легким и обусловлена, как уже было отмечено, силами гравитации. В верхних отделах легких кровоток минимальный. Вентиляция в этих отделах тоже снижена, но в меньшей степени. Поэтому от верхушек легких кровь оттекает с нормальным или даже повышенным напряжением О2, однако в связи с небольшим общим количеством такой крови это мало влияет на степень оксигенации артериальной крови. В нижних отделах легких, напротив, кровоток значительно повышен (в большей степени, чем вентиляция легких). Небольшое снижение напряжения кислорода в оттекающей крови при этом способствует развитию гипоксемии, так как увеличивается общий объем крови с недостаточным насыщением кислородом. Такой механизм гипоксемии характерен для застоя в легких, отека легких различной природы (кардиогенного, воспалительного, токсического).
Использованные источники:
4.Перегрузочная форма сердечной недостаточности, этиология и особенности механизмов развития. Механизмы компенсации.
Перегрузочная форма сердечной недостаточности возник.в результ.чрезмерной нагрузки на сердце.
Существуют варианты в зависимости от того, что страдает:
а) Перегрузочная СН при увеличении преднагрузки.
Преднагрузка – объем крови, притекающий к сердцу. ↑ преднагрузки при гиперволемии, полицитемии, гемоконцентрации, недостаточность клапанов. ↑ преднагрузки(перегрузка объемом) – это увеличении объема перекачиваемой крови.
Патогенез( недостат.клапана сердца аорты): при систоле часть крови возвращается в левый желудочек =>↓диастолич.давления в аорте => кровоснабжение миокарда только в диастолу => ↓ кровенаполнения миокарда и его ишемизация => ↓ сократимости миокарда => развитие СН.
б) Перегрузочная СН при увеличении постнагрузки.
Перегрузка – сопротивление изгнанию крови из желудочков в аорту и легочную артерию. Фактор посленагрузки – ОПСС. При ↑ ОППС -↑ посленагрузка. ↑ постнагрузки – это препятствие при изгнании крови. Таким препятствием может быть артериальная гипертензия, стеноз клапана аорты, сужение аорты и легочной артерии.
Увеличение преднагрузки называют перегрузкой давлением.
Патогенез(стеноз клапана аорты): при систоле сердце прикладывает больше силы для того, чтобы протолкнуть порцию крови через суженное отверстие в аорту => за счет удлинения систолы и укорочения диастолы => кровоснабжение миокарда только в диастолу => ↓ кровенаполнения миокарда и ишемизация миокарда => ↓ сократимости миокарда => на молекулярном и клеточном уровне механизмы патогенеза СН при самых различных причинах и формах СН => нарушение энергообеспечения миокарда => повреждение мембран и ферментных систем кардиомиоцитов => дисбаланс ионов и жидкости в кардиомиоцитах =>расстройства нейро-гуморальной регуляции сердца => ↓ силы и скорости сокращений и расслаблений миокарда => развитие СН.
Компенсированная и декомпенсированная сердечная недостаточность.
Компенсированная СН – состояние, когда поврежденное сердце обеспечивает органы и ткани адекватным кол-ом крови при нагрузке и в покое за счет реализации кардиальных и экстракардиальных механизмов компенсации.
Декомпенсированная СН – состояние, когда поврежденное сердце не обеспечивает органы и ткани адекватным кол-ом крови несмотря на использование механизмов компенсации.
1.Основные этапы становления патофизиологии. Роль отечественных (В.В.Патушев, А.А.Богомолец, И.И.Павлов, И.М.Сеченов, И.Р.Петров, А.М.Чернух, Г.И.Крыжановский) и зарубежных (Р.Вирхов, Ю.Конгейм, Г.Шаде, Г.Селье) ученных.
Первый период(1542-1863)-преподавание пат.физа,ее отдельных эл.вместе с анатомией, физиологией,терапией в основном клинцистами.Впервые применил термин патофизиология Галлиот в 1819г.
Второй период (1863-1924 гг.). Выделением преподавания физиологии и патофизиологии в самостоятельные дисциплины.
Третий период (1924-1950 гг.). В 1924 г.по предложению акад. А.А.Богомольца и проф. С.С.Халатова кафедры общей патологии университетов были переименованы в кафедры пат.физа. Бурное развитием П.Ф.и формированием научных школ, созданием исследовательских институтов.
Четвертый период (с 1950 г. и по настоящее время). Объединению патофизиологов во Всесоюзное общество патофизиологов. С 1957 г. В 1970 г. в Баку прошел I Всесоюзный съезд патофизиологов, а в 1972 г. в Ростове-на-Дону — I международный конгресс патофизиологов. В 1991 г. организуется Международное общество патофизиологов. В результате патофизиология становится наукой, признанной на международном уровне.
Патофизиология — наука, изучающая жизнедеятельность больного организма. Иначе: основные закономерности возникновения, механизма развития (патогенеза) и исхода болезни (выздоровление, реабилитация или смерть).
Задачи патофизиологии:Изучение наиболее общих (типичных) закономерностей отклонений от нормального течения работы клеток и организма в целом. Пашутин- преобразовал общую патологи ю в науку экспериментальную, яв. Автором крупного 1 руководства по патфизу. Богомолец- указал на роль соед ткани в регуляции функций клеток, разделил тк и орг, доказал значение в формировании противоинфекционной и противораковой резистентности орг, разработал антиретикулоэндотелиальную цитотоксическую сыворотку(стимул.функцию соед тк и ↑ резистентность). Петров- изуч.патогенез шока – травматического, ожогового, электрического постгеморрагического, анафил,разработал способы патогенетич.терапии и профилактики шока. Чернух – учение о нейрососудистой регуляции жизнедеятельности клетки при различных пат.процессах вообще и воспалении в частности. Крыжановский-создателем теории генераторных механизмов нейропатологических СД, характеризующихся гиперактивностью систем, основоположник учения о детерминанте. Вирхов— основатель теории клеточной патологии- рассматривает клетку как материальный субстрат болезни, а саму болезнь — как определенную сумму поражений множества отдельных клеток. Конгейм — проследил все стадии воспалит.процесса и описал выхождение лейкоцитов через стенки сосуда как активный процесс эмиграции, их превращение в гнойные шарики и участие в процессе восстановления тканей. Шаде— охарактеризовал типичные физико-химические сдвиги в очагах воспаления: местный ацидоз, гиперосмолярность, накопление ионов калия в интерстициальной жидкости, увеличение тканевого гидростатического давления. Селье— гипотеза общего адаптационного синдрома,
2. Ожирение, виды, этиология, патогенез, последствия. Ожирение – избыточное отложение жира в жировой ткани. Избыток лептина подавляет действие инсулина на клетки печени(инсулин активирует адипоциты,↑ образование лептина, а он воздействует на собственные рецепторы, локализованные на поверхности бета кл, тормозит секрецию инсулина). Первичное ожирение наруш.гормон.связи между жировой тканью и гипоталамусом. Генетическое заболевание, главная черта-абсолютная или относительная лептиновая недостаточность. Вторичное ожирение-сд, нарушение соотношения между липолиза и липогенеза, симптоматический характер и с расстройствами(эндокринопатии, опухоли мозга, нарушения мозгового кровообращения). Степени ожирения – 1ст (масса тела увел на 30%) 2 ст( на 30-50%), 3ст(более чем на 50%).Гипертрофическое ожирение— ↑ размеров адипоцитов. Гиперпластическое ожирение-↑ кол-ва адипоцитов.
По этиологии: экзогенно-конституциональное(переедание), гипоталамическое ожирение(поражения гипоталамуса(травмы гол мозга,опухоли мозга), гормональное ожирение(гипо-, гиперфункцией желез внутренней секреции).По патогенезу: алиментарное(чрезмерном потреблении пищи); метаболическое(↑синтезом жира из углеводов); энергетическое(недостаточное использование жиров в качестве источника энергии).
Последствия: ↓ур. общего белка крови за счет ↓ концентр альбуминов, ↑ фибриногена, продуктов деградации фибрина,↓ ур.гепарина=> наруш.транспорта липидов,↓ фибринолитической активности и ↑ тромбогенных свойств крови=>тромбоэмболий. Возникают нарушения функций ЦНС: утомляемость, сонливость, ухудшение памяти;преждевременное старение, изменения во внутр.органах(жировая инфильтрация печени).
Использованные источники:
Сердечная недостаточность: понятие, формы
Сердечная недостаточность (СН)—типовая форма патологии сердечно-сосудистой системы, характеризующаяся тем, что насосная функция сердца не обеспечивает адекватный метаболическим потребностям организма уровень системной гемодинамики [некомпенсированная форма СН] или поддерживает его благодаря реализации предсуществующих и/или вновь формируемых компенсаторных механизмов организма [компенсированная форма СН].
Формы сердечной недостаточности
Ниже приведены основные формы сердечной недостаточности:
а) острая (минуты, часы);
б) хроническая (недели, месяцы, годы).
Б. По степени выраженности:
B. По патогенезу:
в) смешанная (комбинированная — сочетание миокардиальной и перегрузочной).
Г. По первично-нарушенной фазе сердечного цикла:
Д. По локализации:
а) левожелудочковая, для которой характерны уменьшение выброса крови в аорту, перерастяжение левого сердца и застой крови в малом круге кровообращения;
б) правожелудочковая, для которой характерны уменьшение выброса крови в малый круг кровообращения, перерастяжение правого сердца и застой крови в большом круге кровообращения;
в) тотальная (сочетание лево- и правожелудочковой недостаточности). Дифференциация форм сердечной недостаточности по механизму ее развития наиболее значима для практикующего врача, т.к. позволяет ему сориентироваться в ответе на главный вопрос: «кто виноват в нарушении насосной функции сердца»? Такими «виновниками» могут быть патогенетически значимые изменения: 1) контрактильных свойств миокарда; 2) пред-нагрузки (значительное поступление крови в полости сердце); 3) постнагрузки (снижение оттока крови из полостей сердца).
Миокардиальная форма сердечной недостаточности
Миокардиальная форма сердечной недостаточности возникает при повреждении миокарда в условиях развития ИБС, миокардитов, миокардиодистрофий, кардиомиопатий. Патогенетическую основу данной формы составляют патогенетически значимые изменения одного из двух основных свойств миокарда — сократимости (силы и скорости сокращения кардиомиоцитов) и расслабляемо-сти (скорости и глубины расслабления мышечных волокон после их сокращения).
Перегрузочная форма сердечной недостаточности
Перегрузочная форма сердечной недостаточности развивается в условиях перегрузки сердца:
а) объемом (при пороках сердца с недостаточностью клапанов, врожденном незаращении межжелудочковой перегородки, гиперволемии)
б) сопротивлением (при пороках сердца со стенозами отверстий, коарктации аорты, артериальной гипертензии, полицитемии).
Диастолическая сердечная недостаточность
Установлено, что диастолическая сердечная недостаточность всегда включает диастолическую дисфункцию, но ее наличие еще не свидетельствует о сердечной недостаточности. Диастолическую сердечную недостаточность диагностируют значительно реже, чем диастолическую дисфункцию, и наблюдают не более чем у 1/3 больных ХСН.
Выделяют 3 ступени перехода от диастолической дисфункции к диастолической сердечной недостаточности. На 1-й ступени под влиянием различных повреждающих агентов (перегрузок, ишемии, инфаркта. гипертрофии левого желудочка и т.д.) нарушается процесс активного расслабления миокарда и раннего наполнения левого желудочка, что на этом этапе полностью компенсируется активностью левого предсердия, поэтому не проявляется даже при нагрузках. Прогрессирование заболевания и повышение жесткости камеры ЛЖ сопровождается вынужденным ростом давления заполнения ЛЖ (предсердие уже не справляется!), особенно заметным при нагрузках. Наблюдают еще большее затруднение притока крови к левому желудочку и патологический рост давления в легочной артерии, что снижает толерантность к нагрузкам (2-я ступень). Дальнейший рост давления заполнения ЛЖ (3-я ступень) полностью «выводит из строя» левое предсердие; приток крови к желудочку (отток крови из легких) снижен критически, что сопровождается падением сердечного выброса, резким снижением толерантности и застоем в легких, т. е. формированием развернутой картины ХСН.
Таким образом, переход от диастолической дисфункции левого желудочка к диастолической сердечной недостаточности обусловлен классическим вариантом развития застоя, вызванного уменьшением оттока крови из легких, ухудшением активного расслабления миокарда и повышением жесткости камеры ЛЖ. Ключом к решению проблемы считают улучшение активного расслабления и увеличение податливости камеры левого желудочка.
Другой особенностью диастолической сердечной недостаточности по сравнению с традиционным (классическим) вариантом ее развития является относительно лучший прогноз — уровень годичной летальности при диастолическом варианте примерно в два раза меньше, чем при «классической» систолической хронической сердечной недостаточности. Однако специалисты считают, что такое «благополучие» обманчиво, поскольку смертность от систолической ХСН постоянно снижается, а от диастолической сердечной недостаточности — из года в год остается на одном уровне,что можно объяснить отсутствием достаточно эффективных средств лечения больных с диастолической формой хронической сердечной недостаточности.
При ухудшении насосной функции желудочков сердца увеличение пред-нагрузки способно поддерживать сердечный выброс. В результате этого на протяжении длительного времени происходит ремоделирование левого желудочка: он становится более эллиптоидным, расширяется и гипертрофируется.
Будучи изначально компенсаторными, эти изменения в конечном счете увеличивают диастолическую ригидность и напряженность стенки (миокардиальный стресс), нарушая работу сердца, особенно во время физической нагрузки. Увеличенное напряжение сердечной стенки повышает потребность в кислороде и ускоряет апоптоз (запрограммированная клеточная гибель) миокардиальных клеток.
Использованные источники:
