Ингибиторы ангиотензин превращающего фермента при сердечной недостаточности
Ингибиторы ангиотензин превращающего фермента при сердечной недостаточности
Известно, что ангиотензин II играет ключевую роль в развитии сердечной недостаточности. Эффективность ингибиторов АПФ объясняется тем, что эта группа препаратов препятствует превращению в плазме крови и тканях неак тивного ангиотензина I в ангиотензин П, предупреждая тем самым его небла гоприятное воздействие на сердце, периферическое сосудистое русло, почки, водоэлектролитный баланс и нейрогуморальный статус.
Ингибиторы АПФ у больных сердечной недостаточностью повышают фракцию выброса: от 0,8% (каптоприл) до 4,1% (лиэиноприл).
Кардиальные гемодинамические эффекты этих препаратов:
снижение пред- и постнагрузки, падение артериального давления и частоты сердечных сокращений.
Кардиопротективные свойства: регрессия гипертрофии ЛЖ сердца, уменьшение его дилатации и предотвращение ремоделирования ЛЖ у больных после инфаркта миокарда.
Антиаритмический эффект: при приеме каптоприла число желудоч-ковых экстрасистолий уменьшается в 4 раза.
Диуретическое действие ингибиторов АПФ сравнимо с диуретиками. Происходит нормализация и предотвращение электролитных нарушений. Вы явлены нефропротективные свойства, особенно у больных артериальной гипертонией и сахарным диабетом, вазопротекция и антиоксидантный эффект (каптоприл).
Важнейшие направления действия ингибиторов АПФ: снижение уровня норадреналина, вазопрессина, блокада синтеза альдостерона, разруше ние и инактивация брадикинина, подавление барорефлексов.
Побочные эффекты: ангионевротический отек, связанный с накопле нием под кожей брадикинина: появляется или после первой дозы, или в первые 48 часов от начала лечения. Кашель (3-22% случаев) сухой и нередко «лаю щий» может появиться и в начале лечения, и значительно позднее, даже через несколько месяцев, заставляя порой отказываться от применения ингибиторов АПФ. Имеются данные, что нестероидное противовоспалительное средство сулиндак (200 мг/сут) предотвращает и угнетает кашлевый рефлекс.
Гипотензия возникает часто при тяжелой сердечной недостаточности и высокорениновой тяжелой гипертонии у пациентов пожилого и старческого возраста с выраженным стенозом почечных артерий и при применении боль ших доз диуретиков. Риск гипотензии уменьшают низкие начальные дозы каптоприла — 6,25 мг, эналаприла — 2,5 мг. Есть данные о предпочтительности периндоприла в дозе 2 мг.
Выраженная артериальная гипотензия может лимитировать применение ингибиторов АПФ. Если ее причиной стали гипокалиемия, гипонатриемия, обезвоживание, связанные обычно с неправильным применением диуретиков,
а также различные тахиаритмии, следует восстановить водно-электролитный баланс, нормализовать ритм сердца, уменьшить дозу диуретиков и лишь затем пытаться применить ингибиторы АПФ.
Исходная гипотензия бывает проявлением нераспознанной пневмонии, рецидивирующей тромбоэмболии легочной артерии, терминальной фазой хро нической сердечной недостаточности.
Гиперкалиемия, обусловленная блокированием освобождения надпочечни ками альдостерона, чаще всего развивается при сочетанием применении с препаратами калия и калийсберегающими диуретиками.
Прогрессирование почечной недостаточности происходит преимуществен но при исходно нарушенной функции почек. Рост креатинина и протеинурии заставляет уменьшить суточную дозу ингибитора АПФ и тщательно следить за уровнем креатинина в плазме крови и белка в моче, особенно в первые дни и недели приема препаратов. Для таких больных более безопасен фозиноприл.
КАПТОПРИЛ (КАПОТЕН) стал «золотым стандартом» среди ин гибиторов АПФ.
Содержит сульфгидрильную группу, является активным агентом. Биодоступность — 60%, максимальная концентрация в плазме крови — через час при приеме внутрь, при сублингвальном — гораздо раньше. В первые 4 часа после приема с мочой выделяется 2/3 принятого препарата, за сутки — 95%. Максимальная концентрация свободного несвязанного с белками каптоприла в плазме крови составляет 800 нг/мл, а тотальная (вместе с метаболитами) — 1580 нг/мл.
После приема 12,5 мг каптоприла активность АПФ в плазме крови падает на 40%, угнетение длится до 3 часов. При хронической сердечной недостаточ ности оптимальный гемодинамический эффект дает концентрация в плазме крови 100-120 нг/мл свободного каптоприла, что достигается средней эффек тивной дозой 53 мг/сут.
Во избежание побочных эффектов начинать лечение следует с дозы 6,25-12,5 мг 2-3 раза в день, причем если одновременно больной получает ди уретики, доза должна быть 6,25 мг 2-3 раза в день, постепенно ее увеличивают до оптимальной.
При хронической почечной недостаточности (ХПН) и клиренсе креатини на 10-50 мл/мин обычную дозу дают каждые 12-18 часов, а при клиренсе ме нее 10 мл/мин — каждые 24 часа.
Для больных с сердечной недостаточностью начальная доза каптоприла 6,25 мг и ниже с постепенным ее увеличением до 50-75 мг/сут.
Добавление каптоприла или других ингибиторов АПФ к терапии диуретиками у больных с сердечной недоста точностью повышает ее эффективность.
У некоторых пациентов с очень тяжелой сердечной недостаточностью кап топрил может повышать на 25% уровень дигоксина в плазме крови, что связано с почечной дисфункцией.
Показания: артериальная гипертония, сердечная недостаточность.
Противопоказания: выраженные нарушения функции почек, азотемия, гиперкалиемия, двусторонний стеноз почечных артерий или стеноз единствен ной артерии почки, состояние после трансплантации почек, первичный гипер альдостеронизм, стеноз устья аорты, наследственный отек Квинке, беремен ность, лактация, детский возраст, повышенная чувствительность к каптоприлу и другим ингибиторам АПФ.
Побочные эффекты, специфичные для каптоприла, связаны с наличи ем сульфгидрильной группы. Нейтропения возможна при применении высоких доз, от которых в настоящее время специалисты отказались. Протеинурия в 1% случаев возникает при дозе 150 мг/сут у пациентов, перенесших почечное заболевание.
Извращение вкуса и язвочки на слизистой щек возможны в 2-7% случаев, явления эти дозозависимы. С высокими дозами каптоприла связывают появле ние коллагеновых заболеваний, нарушение иммунного ответа, а также увели чение титра антинуклеарных антител.
ЭНАЛАПРИЛ относится к несульфгидрильным ингибиторам АПФ второго поколения, которым свойственно длительное действие.
После приема внутрь препарат быстро всасывается и гидролизуется с образованием энаприлата — высокоспецифического длительно действующего несулъфгид-рильного ингибитора АПФ. Т 1/2 — около 11 часов. Элиминируется преимущественно с мочой. Коррекция дозы при ХПН начинается с клубочковой фильтрации ниже 80 мл/мин — 5-10 мг/сут, при падении клубочковой фильтрации до 30-10 мл/мин — доза 2,5-5 мг/сут.
При сердечной недостаточности рекомендуется прием 2,5 мг препарата в течение 3 дней с последующим увеличением дозы до 5 мг/сут (в два приема). На второй неделе дозу препарата можно увеличить до 10 мг/сут, доведя при отсутствии тяжелой гипотензивной реакции до 20 мг/сут.
Для пациентов старческого возраста начальная доза составляет 1,25-2,5 мг в день с постепенным повышением до 5-10 мг/сут. При применении первой дозы необходимо мониторирование АД каждые 8 часов во избежание гипотен зивной реакции.
Противопоказания и побочные эффекты аналогичны остальным ингибиторам АПФ.
Биодбступнос”№ — 25-50%, прием пищи не влияет на всасывание препарата. После однократного приема концентрация в крови достигает максимума через 6-8 часов и совпадает с максимальным гипотензивным эффектом. Выделяется в неизмененном виде с мочой. У пожилых концентрация препарата в крови в 2 раза выше, чем у молодых.
ЛИЗИНОПРИЛ. В дозе 10 мг у больных артериальной гипертонией блокирует активность плазменного АПФ на 80% в первые 4 часа с постепенным снижением до 20% к концу суток. У больных с сердечной недостаточностью блокада активности РААС обеспечива ется дозами 1,25-10 мг/сут на 24 часа.
При сердечной недостаточности дозы колеблются от 5 до 20 мг/сут. Во из бежание чрезмерной гипотензивной реакции предпочтительнее начинать с до зы 2,5 мг, постепенно повышая ее до максимальной. При ХПН и клубочковой фильтрации 30-10 мл/мин — 2,5-5 мг, а при клиренсе менее 10 мл/мин — 2,5 мг. Исследования показывают, что, применяя лизиноприл через 24 часа от начала инфаркта миокарда в течение 6 недель, удалось снизить смертность на 12%. Комби нация лизиноприла с нитроглицерином, введенным в/в, позволяет снизить смертность на 17%. У больных, полу чавших лизиноприл, гипотензия развилась в 20% случа ев, а в контрольной группе — в 36%.
Показания: артериальная гипертония, сердечная недостаточность. Противопоказания и побочные эффекты аналогичны другим инги биторам АПФ.
РАМИПРИЛ относится к предлекарству (prodrugs) и превращает ся в организме в активный диацид рамиприлат. Подавление тканевой системы РААС при приеме эквивалентных доз каптоприла и рамиприла в 2 раза выше у последнего.
Абсорбция при приеме внутрь — 60%, в печени превращается в активный метаболит рамиприлат, который при нормальной функции почек выводится с мочой. После приема 5 мг препарата пик концентрации наблюдается через 1,2 часа и составляет 18 нг/мл, а рамиприлата — соответственно 3,2 часа и 5 нг/мл. Период полувыведения рамиприла — 5 часов, а активного метаболита — 13-17 часов. Тканевая кинетика свидетельствует о более длительной элиминации препарата — до 110 часов. С мочой выделяется около 60% рамиприла и его метаболитов, а с фекалиями — 40%. Максимум действия наблюдается в течение 4-6,5 часа и продолжается более 24 часов. Рамиприлат в 6 раз сильнее блокирует АПФ, чем рамиприл.
Показания: артериальная гипертония, сердечная недостаточность.
Лечение начинают с дозы 2,5 мг рамиприла однократно или дважды в день. Больным, получающим диуретики, их либо следует отменить на 2-3 дня, либо начинать с дозы 1,25 мг. При высоком риске гипотензии и при очень тяжелой сердечной недостаточности лечение рекомендуется начинать также с дозы 1,25 мг.
При обезвоживании, уменьшении объема циркулирующей крови, гипонат риемии перед применением рамиприла вводят изотонический раствор хлорида натрия.
Для больных с сердечной недостаточностью доза рамиприла 5 мг эквива лентна каптоприлу 75 мг/сут.
Старческий возраст, наличие почечной и сердечной недостаточности обус ловливают уменьшение почечной секреции рамиприла и его метаболитов, при водят к повышению их концентрации в крови, что требует уменьшения дозы препарата до 2,5 мг/сут или через день.
При ХПН и клубочковой фильтрации ниже 40 мл/мин дозу препарата следует уменьшить вдвое.
Противопоказания и побочные эффекты аналогичны другим инги биторам АПФ.
ПЕРИНДОПРИЛ (ПРЕСТАРИУМ) — ингибитор АПФ пролонги рованного действия. Не содержит сульфгидрильной группы.
Метаболизируясь в печени, превращается в активный метаболит — периндопри-лат. 75% препарата выделяется с мочой, 25% — с фекалиями. Действие в организме сохраняется в течение суток. Начало действия — чаще всего через 1-2 часа, пик эффекта (в частности гипотензивного) — через 4-8 часов. Одновременный прием с пищей тормозит превращение периндоприла в периндоприлат. Связывание с белками составляет 30%, что зависит от концентрации препарата. Т 1/2 препарата — 1,5-3 часа, а его активного метаболита — 25-30 часов.
У больных с сердечной недостаточностью периндоприл в дозе 7.-А мг/сут приводит к положительным гемодинамическим сдвигам — достоверному увели чению сердечного выброса, падению ОПСС, давления в легочной артерии и легочных капиллярах.
При сердечной недостаточности лечение начинают с дозы 2 мг/сут.
При артериальной гипертонии рекомендуются дозы 1-А мг/сут с приемом в утренние часы. В случае недостаточного эффекта дозу можно увеличить до 6-8 мг/сут или принимать препарат в комбинации с диуретиками (например, индапамидом). У пожилых больных суточная доза периндоприла должна быть не выше 2-4 мг. Препарат и его активный метаболит у больных артериальной гипертонией и ХПН при длительном применении накапливаются в организме. Поэтому таким больным его назначают в дозе 2 мг в сутки или через день.
Противопоказания и побочные эффекты аналогичны другим инги биторам АПФ.
ИНГИБИТОРЫ АПФ МОЖНО ПРИМЕНЯТЬ:
* в виде монотерапии при начальных стадиях сердечной недостаточности;
* добавляя к терапии диуретиками и дигоксином при тяжелой сердечной недостаточности;
* в виде комбинации с дигоксином, диуретиками и вазодилататорами при тяжелой сердечной недостаточности.
ПОБОЧНЫЕ ЭФФЕКТЫ И ОСНОВНЫЕ ПРОТИВОПОКАЗАНИЯ
Побочные эффекты, общие для всех ингибиторов АПФ: кашель, гипотен зия (особенно часто при стенозе почечной артерии, тяжелой сердечной недо статочности), изменение функции почек, ангионевротический отек, почечная недостаточность (часто при билатеральном стенозе почечных артерий), гипер калиемия (при почечной недостаточности) или при применении калийсберега ющих диуретиков, кожные реакции.
Побочные эффекты, описанные при применении высоких доз каптоприла: протеинурия, потеря вкуса, повреждение слизистой рта, сухость во рту.
Противопоказания: почечные — билатеральный стеноз почечных артерий или аналогичные изменения, предшествующая гипотензия, тяжелый стеноз аорты или обструктивная кардиомиопатия, беременность.
Использованные источники:
Ингибиторы ангиотензинпревращающего фермента — краеугольный камень лечения сердечной недостаточности
О статье
Авторы: Агеев Ф.Т. (НИИ клинической кардиологии ФГБУ «НМИЦ кардиологии»Минздрава России, Москва), Константинова Е.В. Овчинников А.Г. (ФГБУ «НМИЦ кардиологии» Минздрава России, Москва)
Для цитирования: Агеев Ф.Т., Константинова Е.В., Овчинников А.Г. Ингибиторы ангиотензинпревращающего фермента — краеугольный камень лечения сердечной недостаточности // РМЖ. 1999. №2. С. 5
В августе 1991 г. в журнале «The New England Journal of Medicine» была опубликована редакционная статья видного американского кардиолога, профессора Е. Браунвальда [1], которая «юридически узаконила» новую эру в лечении больных с хронической сердечной недостаточностью (ХСН) — эру ингибиторов ангиотензинпревращающего фермента (ИАПФ).
Длительность гемодинамических эффектов,ч
Фармакокинетика и фармакодинамика ИАПФ. В настоящее время известно более трех десятков ИАПФ (и ежегодно их число увеличивается), которые объединены в 3 группы:
1) содержащие SH-группу (каптоприл, алациприл, зофеноприл); 2) карбоксиалкилдипептиды (эналаприл, лизиноприл, рамиприл, периндоприл, трандалоприл и др.); 3) содержащие фосфинильную группу (фозиноприл). Каждой из групп присущи свои особенности, связанные с отличиями фармакокинетики и фармакодинамики препаратов ( табл. 1 ), что проявляется различиями в длительности и силе воздействия, выраженности побочных явлений, списке показаний и противопоказаний.
Таблица 2. Метаанализ 32 исследований ИАПФ у больных ХСН [2], р 8 нед
Так, например, «эталонный» препарат каптоприл выделяется почками, что ограничивает его использование при нарушении их функции, требует как минимум 2-кратного применения (в тяжелых случаях — 3-4-разового), однако наличие SH-группы в молекуле обеспечивает дополнительное кардиопротективное, нефропротективное и оксидативное действие. Действие карбоксиалкилдипептидов осуществляется с участием активных метаболитов (кроме лизиноприла), что обеспечивает их более длительные эффекты (в том числе и побочные), но требует только 1-2-кратного приема в сутки. Необходимо отметить, что все исследования, в которых было зафиксировано положительное влияние на прогноз так называемых длительных ИАПФ, были выполнены в режиме 2-кратного назначения препаратов. Выделение препаратов этой группы из организма происходит главным образом с мочой, что также вынуждает к осторожному их применению при заболеваниях почек. Этого недостатка лишен фозиноприл, который при высокой активности блокады РААС имеет два механизма выведения — с мочой и через желудочно-кишечный тракт, причем при нарушении функции почек он преимущественно инактивируется печенью, а при печеночной недостаточности максимально активно выделяется почками.
Таблица 3. Зависимость эффекта ИАПФ от тяжести ХСН
Использованные источники:
Ингибиторы апф в терапии сердечной
Недостаточности и артериальных гипертензий:
Современные схемы лечения
Роль ренин — ангиотензиновой системы
Ингибиторы ангиотензин превращающего фермента (АПФ) применяются в клинике два десятилетия. Ингибиторы АПФ — единственный до недавнего времени класс препаратов, лечебное действие которых обусловлено подавлением чрезмерной активности ренин-ангиотензиновой системы (РАС). Со времени открытия РАС еще в начале XX века имеется большой прогресс в изучении роли этой системы, механизмов действия отдельных ее компонентов.
РАС представляет собой сложную ферментативно-гормональную систему, основными компонентами которой являются ангиотензиноген, ренин, ан-гиотенЗин I и II, рецепторы для ангиотензина 11 (табл.1).
Ангиотензин I под действием АПФ превращается в активный октапептид ангиотензин I. Н.Okunishi и соавт. (1987) обнаружили, что АПФ располагается преимущественно в эндотелии сосудов. Но по современным представлениям существует не-АПФ-зависимое образование ангиотензина II в тканях под действием сериновых протеаз, которое происходит, главным образом, в адвентиции сосудов. Так в сердце эта реакция превращения происходит при участии кататализатора химазы. Ангиотензин II является конечным продуктом «ферментного каскада». Связываясь со специфическими рецепторами на клеточных мембранах, ангиотензин II опосредует разнообразные гемодинамические физиологические и биохимические эффекты активации РАС, а также осуществляет саморегуляцию этой системы, подавляя чрезмерную секрецию ренина.
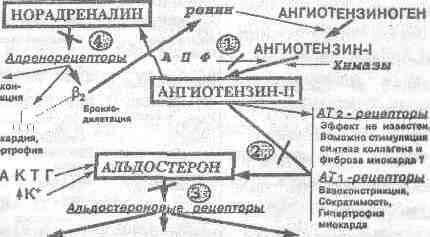
В настоящее время идентифицировано по меньшей мере четыре различных типа рецепторов для ангиотензина П: АТ1-, АТ2-, АТ3-, и АТ4— (R.T.Ederhardt и соавт. 1993, P.M.Kang и соавт., 1994). Все основные сердечно-сосудистые эффекты ангиотензина П опосредуются АТ1-рецепторами, которые подразделяют на два подтипа: АТ1А— АТ1В-.
Тканевое распределение различные подтипов АТ-рецепторов для ангиотензина П неодинаково. В то время как АТ1-рецепторы в большом количестве обнаруживаются в легких, печени, почках, надпочечниках, аорте, селезенке и на некоторых участках головного мозга, АТ1В-рецепторы располагаются преимущественно в гипофизе, надпочечниках, почках и печени, но практически отсутствуют в сердце, головном мозге и селезенке (табл. 1). Строго говоря, РАС начинается с высвобождения ренина и заканчивается связыванием АП со специфическими рецепторами на мембранах клеток-мишеней.
Основные сердечно-сосудистые эффекты ангиотензина П, опосредуемые АТ1-рецепторами представлены в табл. 2.
Секреция альдостерона – лишь один из многих эффектов связывания ангиотензина П со специфическими рецепторами на мембранах соответствующих клеток-мишеней. В настоящее время установлено, что вазоконстрикция, высвобождение катехоламинов, секреция вазопрессина, пролактина и АКТГ – не менее важные эффекты активации РАС, например, при гипертонической болезни и хронической сердечной недостаточности.
В патогенезе гипертонической болезни важную роль играет активация ренин — ангиотензиновой системы, которая регулирует вод но-электролитный баланс и ситемное АД (табл. 3). Признание важной роди активации РАС в патогенезе не только гипертонической болезни, но и других форм артериальной гипертензии (например, реноваскудярной гипертензии, диабетической нефропатии и др.) способствовало, с одной отороны, более углубленному изучению влияния на активность РАС известных гипотензивных препаратов, с другой — созданию новых лекарственных препаратов, способных подавлять активность этой системы на различных уровнях.
Наряду с циркулирующей РАС существуют локальные (иди тканевые) РАС, которые, как полагают, выполняют пара-, ауто- и/или интракринные функции. Образующийся непосредственно в органах и тканях А-II может влиять на функцию соседних клеток (паракринная стимуляция) и оказывать прямое действие на функцию тех клеток, на мембранах которых он образовался под влиянием АПФ (аутокринная стимуляция). Наконец, образование А-II может происходить внутриклеточно и таким образом он может влиять на функцию внутриклеточных органелл (интракринная функция).
По современным представлениям в патогенезе сердечной недостаточности важную роль играет активация системы РАС. Это отражено в современном определении сердечной недостаточности:
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ – ЭТО ПАТОЛОГИЧЕСКОЕ СОСТОЯНИЕ, ПРИ КОТОРОМ ДИСФУНКЦИЯ МИОКАРДА ПРИВОДИТ К НАРУШЕНИЮ СПОСОБНОСТИ СЕРДЦА ОБЕСПЕЧИВАТЬ КРОВОСНАБЖЕНИЕ ОРГАНОВ И ТКАНЕЙ В СООТВЕТСТВИИ С ИХ МЕТАБОЛИЧЕСКИМИ ПОТРЕБНОСТЯМИ И СОПРОВОЖДАЕТСЯ КОМПЛЕКСОМ ГЕМОДИНАМИЧЕСКИХ И НЕЙРОГУМОРАЛЬНЫХ КОМПЕНСАТОРНЫХ МЕХАНИЗМОВ.
Каждый исторический отрезок времени лечение хронической сердечной недостаточности (ХСН) зависело от представлений о патогенезе
развития этого синдрома. На протяжении более 200 лет основным принципом терапии ХСН считалась инотропная стимуляция или «подстегивание» ослабленной насосной функции миокарда. Ведущее значение имели сердечные гликозиды. В период 40-60-х годов ХСН представлялось как синдром «застойный», связанный с избыточной задержкой жидкости в организме, и в терапию мощным потоком влились мочегонные препараты, направленные на разгрузку сердечной деятельности путем уменьшения объема циркулирующей в организме жидкости. В 70-е годы господствовало представление о СН как о циркуляторном расстройстве гемодинамики на различных уровнях.
Изменение во взглядах привело к внедрению в практику лечения большой группы периферических вазодилататоров. С конца 80-х годов. сформировалась концепция о ХСН как синдроме, прежде всего связанном с нейрогуморальными расстройствами в организме.
Использованные источники:
Ингибиторы апф у больных сердечной недостаточностью
Шевченко О.П., Шевченко А.О.
Сердечная недостаточность – важнейший клинический синдром, характеризующийся неуклонным прогрессированием, что приводит к потере трудоспособности и значительно ухудшает качество жизни всё большего количества больных. Увеличение заболеваемости сердечной недостаточностью происходит на фоне все более заметных достижений в лечении больных с болезнями сердца и, в первую очередь, ишемической болезни сердца [1]. В будущем, вероятно, такая тенденция не только не исчезнет, но, скорее, приобретет ещё большую актуальность. Успехи в лечении острого инфаркта миокарда и уменьшение случаев внезапной смерти неизбежно приводит к увеличению количества больных, имеющих дефекты сердечной мышцы, у которых в последующем развивается сердечная недостаточность. В настоящее время количество больных сердечной недостаточностью, обусловленной ишемической болезнью сердца, намного превышает число случаев с иной причиной её развития. Смертность больных с выраженной степенью сердечной недостаточности достигает 40% в год, при этом средняя продолжительность жизни при появлении клинических признаков недостаточности кровообращения составляет около 5 лет [2].
Нейрогуморальная активность и прогрессирование сердечной недостаточности
Симпатическая нервная система и ренин-ангиотензиновая активность являются наиболее важными факторами, влияющими на кровообращение при развитии сердечной недостаточности. Уже на ранних стадиях нарушения гемодинамики активация нейрогуморальных систем позволяет компенсировать снижение кровотока. Усиленная активность симпатической нервной системы приводит к повышению сократимости кардиомиоцитов и увеличению сил натяжения, действующих на стенку левого желудочка как в систолу, так и в диастолу, что приводит к развитию гипертрофии кардиомиоцитов [3].
Если величина повреждения сердечной мышцы небольшая, степень гипертрофии миокарда и расширения полостей сердца может быть умеренно выраженной. На фоне значительной потери массы функционирующего миокарда гипертрофии кардиомиоцитов уже недостаточно, и полость левого желудочка начинает расширяться, что приводит к повышению силы натяжения, действующей на стенку левого желудочка, и дальнейшему увеличению размеров его полости, способствуя прогрессированию патологического процесса.
Повышение активности ренин-ангиотензин-альдостероновой системы (РААС) также способствует развитию гипертрофии и фиброза кардиомиоцитов. Если на краткосрочном этапе активация нейрогуморальной системы позволяет повысить перфузию органов и компенсировать недостаточность кровообращения, то спустя определённый период времени «энергозатратный» механизм, интенсифицирующий работу сердечной мышцы, становится наиболее важным механизмом прогрессирования сердечной недостаточности.
С конца 80-х годов истекшего века прогрессирование сердечной недостаточности и сопровождающую её нейрогуморальную активность стали рассматривать как наиболее важную проблему в кардиологии. Использование в медикаментозной терапии больных недостаточностью кровообращения двух групп лекарственных препаратов – ингибиторов АПФ (ИАПФ) и бета-адреноблокаторов существенно изменило концепцию патогенеза прогрессирования сердечной недостаточности [4].
В крупных исследованиях с многолетним наблюдением, включавших более 200 000 больных, было доказано, что ИАПФ снижают риск смерти от инфаркта миокарда, мозгового инсульта и прогрессирования сердечной недостаточности у больных с синдромом сердечной недостаточности, сниженной фракцией выброса левого желудочка, атеросклерозом коронарных или периферических артерий или сахарным диабетом. Анализы результатов исследований, выполненные различными авторами в разное время, свидетельствуют о том, что прием ингибиторов АПФ снижает смертность на 25%, а частоту госпитализаций – на 35% [5, 6].
Ингибиторы АПФ при лечении сердечной недостаточности
Ингибиторы АПФ представляют собой лекарственные средства, которые одновременно подавляют прессорные системы регуляции АД и активируют вазодепрессорные процессы. Обладая свойствами нейрогуморальных модуляторов, эти препараты подавляют образование таких вазоконстрикторных веществ, как ангиотензин II, альдостерон, а также норадреналин, аргинин-вазопрессин, эндотелин-1. При этом повышается уровень вазодилататоров брадикинина, оксида азота, эндотелиального фактора гиперполяризации, простагландинов Е2 и I2.
Помимо блокирования превращения малоактивного ангиотензина-I в высокоактивный ангиотензин II, ингибиторы АПФ тормозят секрецию альдостерона и вазопрессина. Другой эффект ингибиторов АПФ, также непосредственно связанный с инактивацией этого фермента, связан с предупреждением деградации брадикинина, вызывающего релаксацию гладких мышц сосудов и способствующего высвобождению эндотелиального фактора релаксации – оксида азота NO. Кроме того, под влиянием ингибиторов АПФ снижется синтез других вазоконстрикторных и антинатрийуретических соединений (норадреналина, аргинина-вазопрессина, эндотелина-1), участвующих в патогенезе прогрессирования сердечной недостаточности.
Адренэргическая (симпатическая) и ренин-ангиотензиновая системы тесно связаны. Например, выброс ренина регулируется бета-1-адренорецепторами, а ангиотензин II способствует выбросу норадреналина в синаптическую щель. Таким образом, воздействие на одну из этих систем у больных сердечной недостаточностью позволяет оказывать воздействие и на другую. Вазодилататоры, оказывающие симптоматическое действие и улучшающие гемодинамику у больных сердечной недостаточностью, такие как гидролазин, повышают уровни норадреналина в крови. В отличие от них, ингибиторы АПФ снижают уровни норадреналина в крови, что свидетельствует о подавлении симпатической активности. Снижение уровней норадреналина в плазме крови на фоне приема ИАПФ может быть следствием ослабления ангиотензин II-зависимого выброса норадреналина.
Gilbert E.M et al. в контролируемом двойном слепом перекрестном исследовании назначали больным сердечной недостаточностью лизиноприл в дозе 5–20 мг в течение 12 недель. Как показали результаты исследования, лизиноприл достоверно снижал активность симпатической нервной системы. На фоне терапии лизиноприлом уровни норадреналина в правом предсердии снижались с 695±300 до 287±72 пг/мл, a средняя частота сердечных сокращений снижалась с 83±5 до 75±3 уд/мин [7].
Результатом действия ингибиторов АПФ является выраженное снижение общего периферического сосудистого сопротивления при незначительном повышении ударного и минутного объема сердца без существенного изменения частоты сердечных сокращений. Ингибиторы АПФ повышают сердечный выброс и ударный объем [8, 9].
Положительные гемодинамические эффекты ИАПФ способствуют улучшению сократительной функции миокарда левого желудочка и уменьшению клинических проявлений сердечной недостаточности. При сравнении с другими вазодилататорами, ИАПФ вызывают равномерную (сбалансированную) системную артериальную и венозную вазодилатацию, уменьшают задержку соли и воды в организме, снижая синтез альдостерона [10].
Ингибиторы АПФ показаны как средства первой линии у больных со сниженной сократительной функцией левого желудочка (фракция выброса левого желудочка
Использованные источники:
