Ренин ангиотензин альдостероновая система при сердечной недостаточности
Активизация ренин-ангиотензин-альдостероновой системы — важное звено в патогенезе хронической сердечной недостаточности

Согласно современным представлениям, одно из основных значений в патогенезе развитии ХСН отводится ренин-ангиотензин-альдостероновая системе, все функции которой осуществляются через ангиотензин II. На рубеже 90-х годов с помощью типирования, клонирования обнаружено, что действие ангиотензина П возможно лишь при воздействии на ангиотензиновые рецепторы.
Ангиотензин II — важный компонент ренин-ангиотензин-альдостероновой системы
Ангиотензин II является наиболее важным эффекторным пептидом ренин-ангиотензин-альдостероновой системы вызывает вазоконстрикцию, способствует симпатической трансмиссии, а также задержке солей и воды в почках. Также показана роль ангиотензина II в развитии центральной нервной системы, дифференциации и регенерации. Ангиотензин II действует на структуры мозга по обе стороны гемато-энцефалического барьера, что определяет его способность вызывать жажду, модулировать симпатическую активность на периферии, ослаблять барорецепторный рефлекс, вызывать натрийурез и высвобождать вазопрессин и другие гипофизарные гормоны. Эффекты ангиотензина II при сердечной недостаточности включают гипертрофию левого желудочка сердца и структурные изменения сосудистой сети, сердца и почек (например, формирование неоинтимы, постинфарктное ремоделирование, нефросклероз.
Рецепторы к ангиотензину (AT1 и АТ2) — структурные компоненты ренин-ангиотензин-альдостероновой системы
Идентифицированы два основных подтипа рецепторов к ангиотензину II: тип 1 (AT1) и тип 2 (АТ2). Оба подтипа имеют много общего, так как обладают аналогичной геометрией, при которой они содержат полипептидные цепи с около 360 аминокислотами, формирующими семикратно сложенную трансмембранную гирлянду, соединенную при активации с внутриклеточными G-протеинами. Но здесь гомогенность заканчивается, так как определяется гомология только 30 % аминокислотной последовательности. Более того, AT1-рецепторы генетически связаны с хромосомой 3, в то время как ген рецептора к ангиотензину II локализован в Х-хромосоме. В организме животных описаны также подтипы 3 и 4 ангиотензиновых рецепторов, однако, у человека эти рецепторы не были обнаружены.
Несмотря на то, что рецепторы к ангиотензину II принадлежат к одному семейству рецепторов, их сигнальные механизмы и функции различаются.
Рецепторы AT1 фактически ответственны за все известные действия ангиотензина II.
Ренин-ангиотензин-альдостероновая система — Эффекты ангиотензина II, реализуемые через AT1-рецепторы (по R. Willenheimer, 1999):
- Вазоконстрикция
- Задержка жидкости и натрия (продукция альдостерона)
- Гипертрофия миоцитов и гладкомышечных клеток
- Фиброз миокардиальной и сосудистой стенки (синтез и отложение коллагена)
- Гиперплазия фибробластов
- Цитотоксические влияния на миокард
- Увеличение секреции эндотелина-1
- Повышение высвобождения вазопрессина
- Активация симпатической нервной системы
- Стимулирование образования супероксида
- Увеличение уровня ингибитора активатора плазминогена
- Изменение генной экспрессии
Их роль была хорошо документирована после выделения рецептора и определения локализации гена. Связывание ангиотензина II с AT1-рецептором приводит к последующей реализации большинства периферических и центральных эффектов ангиотензина II на артериальное давление, осморегуляцию и клеточный рост, и, таким образом, опосредует патофизиологическое действие ренин-ангиотензин-альдостероновой системы при заболеваниях сердца, сосудов и почек. Распределение рецепторов AT1 у взрослых людей повсеместное, включая сосудистую сеть, почки, надпочечники, сердце, печень и головной мозг. Они вовлечены в механизмы вазоконстрикции, сократимости миокарда, высвобождения альдостерона и вазопрессина, задержки солей в почках, механизмы сосудистой и сердечной гипертрофии.
О сигнальных механизмах и фармакологических эффектах рецепторов АТ2 известно значительно меньше. Если в фетальных тканях они присутствуют повсеместно, то у взрослых в высоких концентрациях определяются только в надпочечниках, матке, яичниках, сосудистом эндотелии и некоторых участках головного мозга. Повышенная экспрессия или доминирование АТ2-рецепторов происходит при патофизиологических состояниях, таких как хроническая сердечная недостаточность, после перенесенного инфаркта миокарда, заболеваниях почек и нервной системы. Предполагается, что АТ2-рецепторы вовлечены в ингибирование пролиферации клеток и, возможно, в клеточную дифференцировку, развитие, регенерацию и даже программированную клеточную смерть (апоптоз).
Проведенные исследования подтверждают гипотезу, что АТ2-рецепторы опосредуют антипролиферацию при изучении поврежденных сонных артерий крысы. Обнаружено, что формирование неоинтимы снижалось на 70 % после трансфера гена АТ2 — рецептора. Аналогично, перенос гена АТ2-рецепторов в культуру гладкомышечных клеток аорты крысы уменьшал пролиферацию клеток. Таким образом, вышеприведенные данные предполагают, что стимулирование АТ2-рецепторов может ингибировать и, возможно, вызывать обратное развитие способствующих росту эффектов ангиотензина II через AT1-рецепторы. Кроме того, ангиотензин II воздействием на АТ2-рецепторы способствует развитию нейронов в различных клеточных линиях нейронного происхождения. Параллельно с этими морфологическими изменениями, стимулирование АТ2-рецепторов модулирует экспрессию важных белковых волокон и, таким образом, прямо вовлечено в развитие нейронов путем реорганизации цитоскелета.
Предполагается, что ангиотензин II может взаимодействовать с системой брадикинин/NO по АТ2-рецепторзависимому механизму, улучшая эндотелиальную и миокардиальную функции. В проведенных экспериментальных работах ангиотензин II стимулировал продукцию цГМФ в интерстициальной жидкости почек крысы и в аорте. Эти эффекты предупреждаются ингибированием синтазы NO, а также блокадой рецепторов к брадикинину Б2.
Экспериментальные исследования показывают, что пептид ангиотен-зин(1-7) образуется как из ангиотензина I,так и из ангиотензина II под влиянием эндопептидазы. Этот пептид вызывает повышение содержания NO путем стимуляции специфических AT1-7 рецепторов или АТ2-рецепторов. Более того, через AT1-рецепторы ангиотензин II вызывает формирование супероксида, который разрушает оксид азота. Следовательно, во время блокады AT1-рецепторов увеличивается содержание оксида азота вследствие снижения образования оксида азота.
Таким образом, повышенная активность NO, наблюдаемая при лечении ингибиторами ангиотензин-превращающего фермента, также присутствует во время терапии с антагонистами AT1-рецепторов. Основываясь на экспериментальных данных, антагонисты AT1-рецепторов обладают потенциалом для более эффективного противодействия неблагоприятной нейрогуморальной активации при ХСН, чем ИАПФ.
Точная оценка влияния ИАПФ на компоненты ренин-ангиотензин-альдостероновой системы всегда представляла трудности, так как АПФ является в основном тканевым ферментом, более чем 90 % которого образуется и действует в эндотелии легочных сосудов. Поэтому было показано, что эффекты ИАПФ не всегда параллельны способности этих препаратов подавлять активность ангиотензинпревращающего фермента, определяемую в плазме крови, т.е. эффекты всех ИАПФ имеют как бы два уровня: плазменный, проявляющийся немедленно после начала терапии, и тканевой – действующий через недели и даже месяцы после начала лечения.
Образование ангиотензина II происходит разными путями и под влиянием различных нейрогормонов. Как стало ясно, только 10-15 % ангиотензина II синтезируется при непосредственном участии АПФ и лишь эта часть образующегося ангиотензина II может контролироваться ИАПФ. Значительно большая часть ангиотензина II синтезируется под влиянием других ферментов — химазы, тонина, катепсина G, пептидилдипептидазы эндотелиальных клеток, почечной карбоксипептидазы. Кроме того, образование ангиотензина II может происходить и непосредственно из ангиотензиногена, минуя образование ангиотензина I как промежуточного продукта. Из этого следует, что влияние ИАПФ на образование ангиотензина II является неспецифическим и неполным.
В связи с этим можно предположить, что и синтез альдостерона не может полностью контролироваться применением ИАПФ. Поэтому большой интерес вызывает применение ингибиторов активных компонентов ренин-ангиотензин-альдостероновой системы — антагонистов рецепторов ангиотензина II и конкурентных антагонистов альдостерона.
Таким образом, ренин-ангиотензин-альдостероновая система играет важнейшую роль в патогенезе ХСН (хронической сердечной недостаточности).
Диуретики влияют на систему РААС.
Полезно знать
© VetConsult+, 2016. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
Использованные источники:
Ангиотензин-ренин-альдостероновая система: схема, функции и ее роль
Ренин-ангиотензин-альдостероновая система является комплексом ферментов и гормонов, которые поддерживают гомеостаз. Регулирует равновесие соли и воды в организме и уровень артериального давления.
Механизм работы
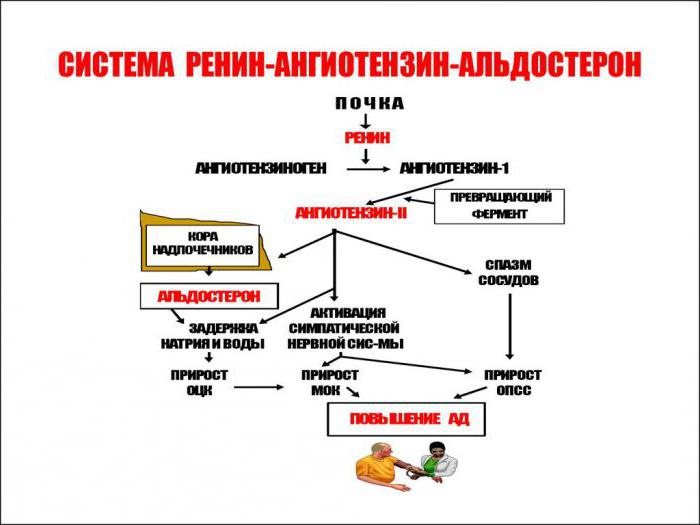
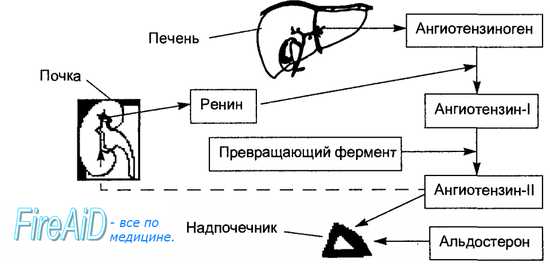
Физиология ренин-ангиотензин-альдостероновой системы берет начало на границе коркового и мозгового вещества почки, где имеются юкстагломерулярные клетки, вырабатывающие пептидазу (фермент) — ренин.
Ренин является гормоном и начальным звеном РААС.
Ситуации, при которых ренин выделяется в кровь
Существует несколько состояний, при которых идет попадание гормона в кровеносное русло:
- Уменьшение кровотока в ткани почек — при воспалительных процессах (гломерулонефрит др.), при диабетической нефропатии, опухолях почек.
- Снижение объема циркулирующей крови (при кровотечении, многократной рвоте, поносах, ожогах).
- Падение уровня артериального давления. В артериях почек имеются барорецепторы, которые реагируют на изменение системного давления.
- Изменение концентрации ионов натрия. В организме человека имеются скопления клеток, которые отвечают на изменение ионного состава крови стимуляцией выработки ренина. Соль теряется при обильном потоотделении, а также при рвоте.
- Стрессы, психоэмоциональные нагрузки. Юкстагломерулярный аппарат почки иннервируется симпатическими нервами, которые активируются при негативных психологических влияниях.
В крови ренин встречается с белком — ангиотензиногеном, который вырабатывается клетками печени и забирает у него фрагмент. Образуется ангиотензин I, который является источником воздействия для ангиотензинпревращающего фермента (АПФ). В итоге получается ангиотензин II, который служит вторым звеном и является мощным вазоконстриктором артериальной системы (суживает сосуды).
Эффекты ангиотензина II
Цель: повысить артериальное давление.
- Способствует синтезу альдостерона в клубочковой зоне коры надпочечников.
- Воздействует на центр голода и жажды в головном мозге, вызывая «солевой» аппетит. Поведение человека становится мотивированным на поиск воды и соленой пищи.
- Влияет на симпатические нервы, способствуя высвобождению норадреналина, который тоже является вазоконстриктором, но менее слабым по действию.
- Воздействует на сосуды, вызывая их спазм.
- Участвует в развитии хронической сердечной недостаточности: способствует пролиферации, фиброзу сосудов и миокарда.
- Снижает скорость клубочковой фильтрации.
- Тормозит выработку брадикинина.
Альдостерон — третий компонент, который действует на конечные канальцы почек и способствует выделению из организма ионов калия, магния и обратному всасыванию (реабсорбции) натрия, хлора, воды. Благодаря этому возрастает объем циркулирующей жидкости, поднимаются цифры артериального давления, и усиливается почечный кровоток. Рецепторы к альдостерону имеются не только в почках, но и в сердце, сосудах.
Когда организм достигает гомеостаза, начинают вырабатываться вазодилататоры (вещества, расширяющие сосуды) — брадикинин и каллидин. А компоненты РААС разрушаются в печени.
Схема ренин-ангиотензин-альдостероновой системы
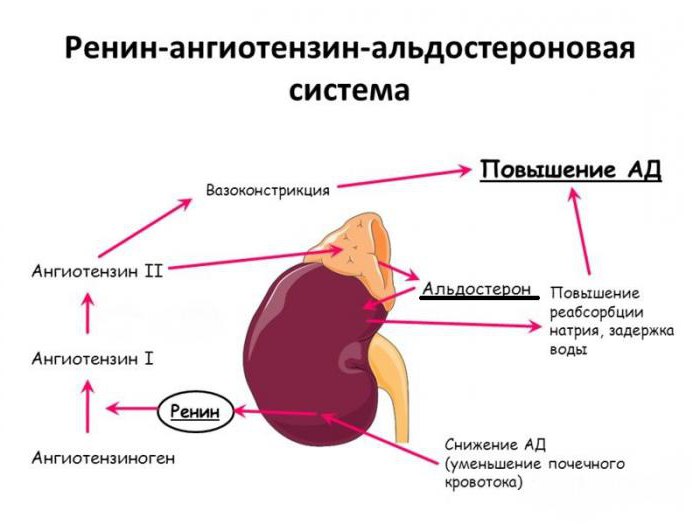
Как любая система, РААС может давать сбой. Патофизиология ренин-ангиотензин-альдостероновой системы проявляет при следующих состояниях:
- Поражение коры надпочечников (инфекция, кровоизлияние и травма). Развивается состояние нехватки альдостерона, и организм начинает терять натрий, хлор и воду, что приводит к уменьшению объема циркулирующей жидкости и снижению артериального давления. Состояние компенсируют введением солевых растворов и стимуляторов рецепторов к альдостерону.
- Опухоль коры надпочечников приводит к избытку альдостерона, который реализует свои эффекты и повышает давление. Также активизируются процессы деления клеток, возникает гипертрофия и фиброз миокарда, и развивается сердечная недостаточность.
- Патология печени, когда нарушается разрушение альдостерона и происходит его накопление. Патология лечится блокаторами рецепторов к альдостерону.
- Стеноз почечной артерии.
- Воспалительные заболевания почек.
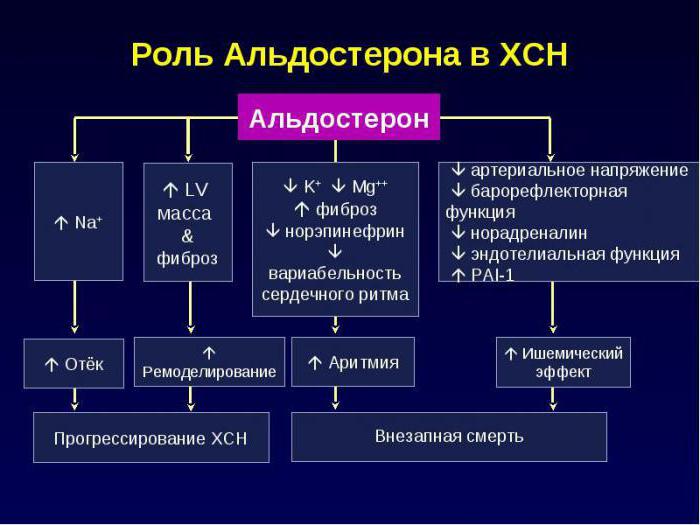
Значение РААС для жизни и медицины
Ренин-ангиотензин-альдостероновая система и ее роль в организме:
- принимает активное участие в поддержании нормального показателя артериального давления;
- обеспечивает равновесие воды и солей в организме;
- поддерживает кислотно-основной баланс крови.
Система может давать сбой. Воздействуя на ее компоненты, можно бороться с гипертонической болезнью. Механизм возникновения почечной гипертензии также тесно связан с РААС.
Высокоэффективные группы препаратов, которые синтезированы благодаря изучению РААС
- «Прилы». Ингибиторы (блокаторы) АПФ. Ангиотензин I не переходит в ангиотензин II. Нет вазоконстрикции — нет повышения артериального давления. Препараты: Амприлан, Эналаприл, Каптоприл и др. Ингибиторы АПФ значительно улучшают качество жизни больных сахарным диабетом, обеспечивая профилактику почечной недостаточности. Препараты принимают в минимальной дозировке, которая не вызывает снижения давления, а лишь улучшает местный кровоток и клубочковую фильтрацию. Медикаменты незаменимы при почечной недостаточности, хронической болезни сердца и служат одним из средств лечения гипертонической болезни (если нет противопоказаний).
- «Сартаны». Блокаторы рецепторов к ангиотензину II. Сосуды не реагируют на него и не сокращаются. Препараты: Лозартан, Эпросартан и др.
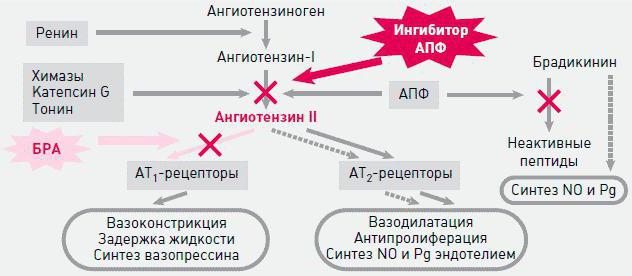
Противоположной ренин-ангиотензин-альдостероновой системе является кининовая. Поэтому блокирование РААС приводит к повышению в крови компонентов кининовой системы (брадикинин и др.), что благоприятно влияет на ткани сердца и стенки сосудов. Миокард не испытывает голодания, потому как брадикинин усиливает местный кровоток, стимулирует выработку естественных вазодилататоров в клетках мозгового вещества почек и микроцитах собирательных трубочек — простагландинов Е и И2. Они нейтрализуют прессорное действие ангиотензина II. Сосуды не спазмированы, что обеспечивает адекватное кровоснабжение органов и тканей организма, кровь не задерживается и снижается формирование атеросклеротических бляшек и тромбов. Кинины благоприятно воздействуют на почки, увеличивают диурез (суточное выделение мочи).
Использованные источники:
Ренин ангиотензин альдостероновая система при сердечной недостаточности
При ослаблении сократительной функции сердечной мышцы и появлении застойных явлений в организме больного норадреналин, высвобождающийся из окончаний симпатических нервов, возбуждая b1-адренорецепторы клеток юкстагломерулярного аппарата, стимулирует секрецию ренина. Другим стимулом секреции ренина является снижение почечного кровотока в результате вызванной катехоламинами (через а-адренорецепторы) констрикции эфферентных артериол почечных клубочков.
Позже усугубить эти механизмы может диуретическая терапия, которая способствует увеличению транспорта натрия хлорида через стенку почечных канальцев.
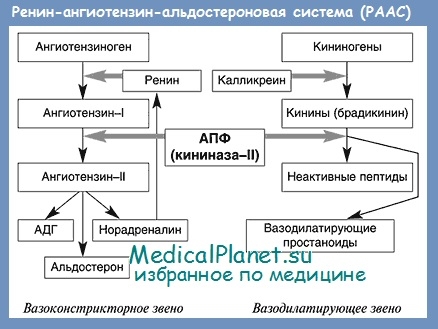
Известно, что ренин-ангиотензин-альдостероновая система (РААС) играет важную роль в регуляции артериального давления и водно-электролитного обмена. В последние годы получены убедительные доказательства того, что чрезмерная активация РААС, которая обнаруживается у большинства больных ХСН, является независимым от других факторов показателем неблагоприятного прогноза.
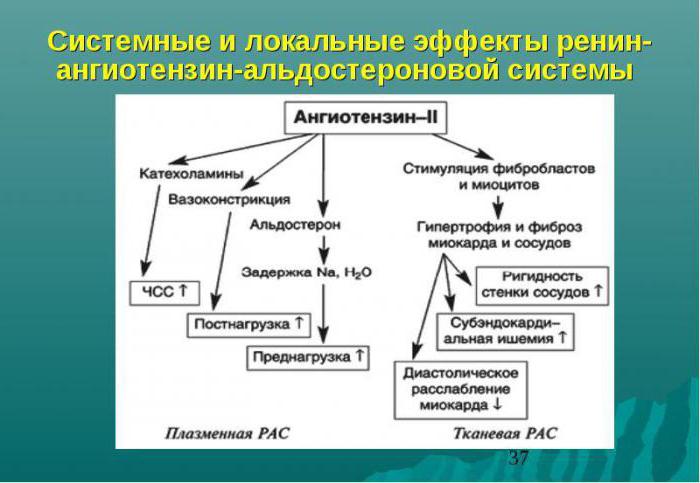
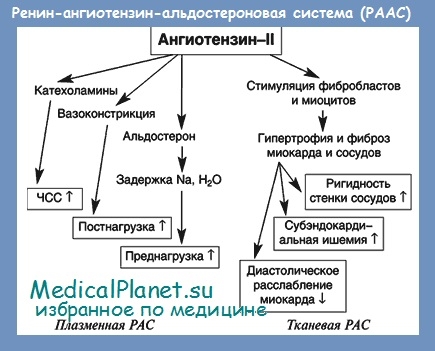
Ангиотензин II играет центральную роль в РААС. В частности, он является мощным вазоконстриктором, несколькими путями повышает артериальное давление, вызывает тахикардию, приводит к ремоделированию миокарда. Ангиотензин II способствует задержке в организме натрия и воды. Эти действия прямо или косвенно опосредуются через симпатическую нервную систему, антидиуретический гормон, альдостерон или угнетение активности блуждающего нерва.
Ангиотензин II оказывает существенное влияние на миокардиоциты и участвует в ремоделировании миокарда как после инфаркта, так и при других заболеваниях. Ремоделирование миокарда, развивающееся в этих случаях, является непременным фактором, определяющим течение и исходы ХСН.
Роль ангиотензина II в развитии ХСН существенно повышается при наличии у больных атеросклеротических изменений в коронарных артериях. В таких случаях ангиотензин II способствует усиленному окислению ЛПНП, ускоренному прогрессированию атеросклероза, появлению нестабильных атеросклеротических бляшек. Известно, что ангиотензин II образуется непосредственно в тканях, в том числе в сердце и сосудах, где, как и во многих других органах, имеется собственная ангиотензиновая система.
В пораженных атеросклерозом артериях эта система особенно активна (Н.А. Грацианский).
Ангиотензин II способствует также образованию супероксида кислорода, который приводит к разрушению важнейшего вазодилатирующего фактора — NО (окиси азота). Вследствие этого снижается вазодилатирующая функция сосудистого эндотелия, возникают ишемические изменения в миокарде, снижается его сократительная функция.
Совокупность этих изменений может быть причиной разрушения или разрыва атеросклеротических бляшек, возникновения вазоспастических явлений в сердце, что может вызывать обострение ИБС, появление нестабильных форм стенокардии и инфаркта миокарда, внезапную коронарную смерть, развитие острой и хронической сердечной недостаточности.
Ангиотензин II считается главным эффекторным пептидом РААС. Почти все известные эффекты активации РААС в крови, органах и тканях обусловлены влиянием ангиотензина П на его специфические рецепторы.
Большое практическое значение имеет то, что образование главного эффекторного пептида РААС — ангиотензина II — может происходить без участия как ангиотензин I-превращающего фермента, так и ренина.
Подавляя активность АПФ с помощью ингибитора АПФ, можно снизить уровень ангиотензина II и тем самым повлиять на механизмы обратной связи. Благодаря этому ингибиторы АПФ способны оказывать положительное влияние на течение сердечной недостаточности.
Компенсаторный характер нейрогуморальных изменений, повышение активности симпатической и ангиотензин-альдостероновой систем на раннем этапе застойной сердечной недостаточности заключаются в том, что возникают вазоконстрикция, компенсаторная тахикардия, гипертрофия миокарда и умеренная (по старой терминологии — тоногенная) дилатация сердца.
Адаптивный характер этих изменений проявляется, в частности, в том, что активизация РААС при начинающейся сердечно-сосудистой недостаточности способствует поддержанию артериального давления на уровне, обеспечивающем достаточный кровоток и перфузию кислорода в жизненно важных органах. Однако по мере прогрессирования заболевания компенсаторные реакции постепенно дают противоположные результаты. Длительная активация РААС приводит к прогрессированию заболевания и ухудшению прогноза.
Гиперактивация симпатического отдела нервной системы сопровождается повышением в плазме крови уровня норадреналина, что также обусловливает вазоконстрикцию, усиление тахикардии, задержку в организме натрия и воды. Нарастание симпатической активности может в определенной мере ослабляться вследствие того, что активность адренергических рецепторов саморегулируется по механизму отрицательной обратной связи. При этом, однако, может нарушаться функция барорецепторов, что вызывает дальнейшее повышение активности САС.
Повышенный уровень норадреналина в плазме крови является следствием увеличения его секреции с одновременным снижением клиренса. Норадреналин плазмы крови экскретируется в основном почками. При сердечной недостаточности в результате снижения клубочковой фильтрации клиренс норадреналина снижается и соответственно увеличивается его уровень в плазме. Ингибиторы АПФ могут снижать содержание норадреналина в плазме крови и нормализовать опосредованные САС рефлексы. Возможно, это происходит благодаря саморегуляции активности адренергических рецепторов.
Многими исследователями показана бесспорная связь между высоким уровнем циркулирующего норадреналина и повышенной летальностью больных с хронической застойной сердечной недостаточностью. Отрицательное воздействие избытка катехоламинов на сердце обусловлено многими факторами: прямым кардиотоксическим эффектом, непрямым влиянием за счет активации нейрогуморальных механизмов и повышения общего периферического сопротивления, активизацией свертывающей системы крови, нарушением функции бета-адренорецепторов, частыми нарушениями сердечного ритма и т.д.
Чрезмерная симпатическая активность вызывает повреждение миокардиоцитов вплоть до их некроза.
При сердечной недостаточности возрастает активность барорецепторов, что ведет к повышению симпатической стимуляции сердца и периферических сосудов. Ангиотензин II может вызывать еще большее повышение симпатической активности.
Определенное значение в патогенезе сердечной недостаточности имеет изменение концентрации в крови предсердного натрийуретического фактора. Известно, что этот фактор секретируется миокардом предсердий и желудочков. Повышение напряжения стенок предсердий или желудочков, обычно связанное с ростом давления наполнения соответствующих камер сердца, является основным стимулом для увеличенной секреции предсердного натрийуретического фактора.
Предсердный натрийуретический фактор способствует дилатации артерий, он снижает вазоконстрикторный эффект, обусловленный другими нейрогормонами, стимулирует экскрецию натрия и воды из организма. При сердечной недостаточности выраженность этого вазодилататорного эффекта снижается из-за вазоконстрикторных эффектов других гормонов и потенциально положительное влияние предсердного натрийуретического фактора на функцию почек ослабевает.
Еще одно из звеньев патогенеза сердечной недостаточности связано с изменением содержания в крови антидиуретического гормона. Повышенная активность симпатико-адреналовой и ренин-ангиотензин-альдостероновой систем стимулирует секрецию антидиуретического гормона клетками задней доли гипофиза. Повышение уровня ангиотензина II также может стать важным стимулом увеличения секреции антидиуретического гормона.
Антидиуретический гормон резко уменьшает экскрецию воды почками, увеличивает ее реабсорбцию в дистальных канальцах и собирательных трубочках, значительно усиливает задержку воды в организме. Кроме того, он может вызвать распространенную вазоконстрикцию. На фоне высокой концентрации в крови больных с застойной сердечной недостаточностью антидиуретического гормона резко снижается экскреция натрия и выводы почками, нарастают отеки, увеличивается жажда (часто становится нестерпимой). Очень высокое содержание антидиуретического гормона часто выявляется у больных с сердечной недостаточностью, которые длительно лечатся большими дозами диуретиков-салуретиков.
Следует учитывать, что с помощью ингибиторов АПФ можно существенно снизить уровень антидиуретического гормона.
— Вернуться в раздел нашего сайта «кардиология»
Использованные источники:
Ренин-ангиотензин-альдостероновая система: что это, функции
Ещё в конце ХІХ века стало известно, что почки принимают активное участие в регуляции артериального давления. Они вырабатывают фермент – ренин, который с ангиотензином и альдостероном составляет РААС (ренин-ангиотензин-альдостероновую систему). Они влияют на водно-солевой обмен, артериальное давление (именно поэтому различные патологии почек сопровождаются гипертензией) и выполняют другие функции.
Что такое ренин-ангиотензин-альдостероновая система
Казалось бы, ренин – фермент, вырабатываемый почками, ангиотензиноген – гликопротеид, синтезируемый печенью, а альдостерон вообще гормон надпочечников – что между ними общего. Тем не менее, они составляют единую систему, которая запускается выработкой ренина в юкстагломерулярных клетках почек.
Существует несколько механизмов стимуляции синтеза фермента:
- Макулярный. Он срабатывает, если снижается поступление ионов натрия в дистальном извитом канальце.
- Внутрипочечный барорецепторный. Юкстагломерулярные клетки являются барорецепторами, они воспринимают растяжение стенок артериол, соответственно реагируют на снижение давления выработкой ренина.
- Симпатический. Юкстагломерулярные клетки иннервируются симпатической нервной системой, и как только к ним поступает сигнал, они тут же начинают синтезировать фермент, способствующий повышению давления. Именно поэтому при стрессах, психо-эмоциональных нагрузках возникает артериальная гипертензия.
Затем ренин поступает в кровь. Там он воздействует на гликопротеин ангиотензиноген, вырабатываемый печенью. Таким образом, ангиотензиноген превращается в ангиотензин І. Под влиянием ангиотензинпревращающего фермента (АПФ) отщепляется дипептид у ангиотензина І, и он становится самым мощным сосудосуживающим средством – ангиотензином ІІ. Кроме того, что он вызывает спазм гладкой мускулатуры, тормозит выработку брадикинина, он стимулирует синтез альдостерона. Этот гормон, вырабатываемый надпочечниками:
- удерживает ионы натрия и воду;
- выводит калий;
- усиливает синтез АТФ-азы воздействуя на ДНК.
Как только нормализуется концентрация натрия в крови, прекращается выработка ренина. Все продукты реакций распадаются, давление нормализуется, и начинают синтезироваться вазодилататоры:
Стимулироваться работа ренин-ангиотензин-альдостероновой системы может из-за различных патологий. Например, при стенозе почечной артерии запускается РААС. Из-за того, что вырабатывается эффективнейший вазоконстриктор ангиотензин ІІ, возникает спазм сосудов. А это приводит к неоправданной гипертонии. Давление значительно повышается, соответственно нарушается микроциркуляция крови. К органам приносится меньшее количество питательных веществ, жизненно необходимых микроэлементов и кислорода (без него клетки мозга начинают отмирать через 5 минут).
Функции РААС
Как только в дистальных канальцах почек понижается концентрация ионов натрия, на юкстагломерулярные клетки подаётся сигнал от симпатической нервной системы, барорецепторы реагируют на расширение стенки артериол, тут же включается ренин-ангиотензин-альдостероновая система. Все реакции происходят практически мгновенно, но даже за столь незначительное время РААС справляется со своими функциями:
- поддерживает кислотно-щелочной баланс;
- регулирует водно-солевой обмен;
- влияет на восстановление объёма крови;
- усиливает скорость клубочковой фильтрации.
На протекание химических реакций влияет кислотно-щелочной баланс. В организме он поддерживается благодаря работе почек, буферных систем и лёгких. Если в крови понижается концентрация натрия, запускается РААС. Под влиянием альдостерона ионы возвращаются в кровь и соединяются с анионами, тем самым создают щелочную среду. Из организма выводятся кислоты в виде аммонийных солей (мочевины). Этот процесс способствует сохранению в организме необходимых минералов (натрия, калия, магния) и выведению токсинов.
Как только под влиянием РААС в крови из-за увеличения солей повышается осмотическое давление, стимулируется выработка вазопрессина, оказывается влияние на синтез альдостерона.
- При понижении концентрации хлорида натрия под воздействием гормонов удерживается в организме натрий и выводится вода. Так в организме сохраняется необходимое количество солей.
- Как только концентрация хлорида натрия повысилась, перестаёт работать РААС. В почечных клубочках происходит выведение избытка солей из организма.
Таким образом регулируется водно-солевой обмен и тем самым поддерживается:
- необходимый объём крови;
- нормальная концентрация натрия.
Кроме вазопрессина и альдостерона регуляцию водно-солевого баланса осуществляет и ангиотензин. Когда количество воды в крови снижается, он сужает стенки сосудов, чтобы временно поддержать нормальное артериальное давление (если объём крови недостаточный, возникает гипотензия) и обеспечить все органы необходимыми веществами. Также он влияет на центр жажды, расположенный в 3 желудочке головного мозга, из-за чего начинает хотеться пить. Как только в организм поступает необходимая жидкость и соли, перестаёт вырабатываться ренин. На этом работа РААС временно прекращается.
Если в организме произошёл сбой ренин-ангиотензин-альдостероновой системы, например, из-за:
Это приведёт к тому, что будет постоянно повышенное давление.
Кроме того, ангиотензин ІІ оказывает прямое воздействие на центральную нервную систему, возникает импульс, который буквально даёт команду гладкой мускулатуре сократиться. Сжимаются стенки сосудов, учащается сердцебиение, поднимается артериальное давление.
Изучение механизма действия РААС привело к тому, что были изобретены эффективные гипотензивные препараты:
- блокаторы рецепторов к ангиотензину;
- ингибиторы АПФ.
Все эти медикаменты влияют на отдельные элементы цепочки выработки ренина, превращения ангиотензина, синтеза альдостерона. Естественно, они негативно влияют на работу системы и способствуют понижению артериального давления.
Вывод
РААС принимает активное участие в водно-солевом обмене, поддержании нормального давления и кислотно-щелочного баланса в крови. За считанные доли секунд вырабатывается ренин, ангиотензин и альдостерон, которые регулируют постоянный объём крови и необходимую концентрацию воды и солей. Однако и эта система может давать сбои, возникающие из-за болезней почек, надпочечников, а это приводит к патологическому повышению давления. Вот поэтому при гипертензии обязательно необходима консультация уролога, нефролога.
Общий видеообзор ренин-ангиотензин-альдостероновой системы:
Использованные источники:
Ренин ангиотензин альдостероновая система при сердечной недостаточности
Марганец – кофактор аминоацил-тРНК синтетаз.
Биологическая роль Na + , Cl — , K + , HCO3— — основных электролитов, значение в регуляции КОС. Обмен и биологическая роль. Анионная разность и ее коррекция.
Тяжелые металлы (свинец, ртуть, медь, хром и др.), их токсическое действие.
Повышение содержание хлоридов в сыворотке крови: обезвоживание, острая почечная недостаточность, метаболический ацидоз после диареи и потери бикарбонатов, респираторный алкалоз, травма головы, гипофункция надпочечников, при длительном приеме кортикостероидов, тиазидный диуретиков, гиперальдостеронизм, болезнь Кушенга.
Снижение содержания хлоридов в сыворотке крови: алкалоз гипохлоремический (после рвоты), ацидоз респираторный, избыточное потоотделение, нефрит с потерей солей (нарушение реабсорбции), травма головы, состояние с увеличением объема внеклеточной жибкости, калит язвенный, болезнь Аддисона (гипоальдостеронизм).
Повышенное выделение хлоридов с мочой: гипоальдостеронизм (болезнь Аддисона), нефрит с потерей солей, повышенный прием соли, лечение диуретиками.
Снижение выведения хлоридов с мочой: Потеря хлоридов при рвоте, диареи, болезнь Кушинга, терминальная фаза почечной недостаточности, ретенция соли при образовании отеков.
Содержание кальция в сыворотке крови в норме 2,25-2,75 ммоль/л.
Выделение кальция с мочой в норме 2,5-7,5 ммоль/сут.
Повышение содержание кальция в сыворотке крови: гиперпаратиреоз, метастазы опухолей в костную ткань, миеломная болезнь, сниженное выделение кальцитонина, передозировка витамина Д, тиреотоксикоз.
Снижение содержания кальция в сыворотке крови: гипопаратиреоз, увеличение выделения кальцитонина, гиповитаминоз Д, нарушение реабсорбции в почках, массивная гемотрансфузия, гипоальбунемия.
Повышенное выделение кальция с мочой: длительное воздействие солнечных лучей (гипервитаминоз Д), гиперпаратиреоз, метастазы опухолей в костную ткань, нарушение реабсорбции в почках, тиреотоксикоз, остеопороз, лечение глюкокортикоидами.
Снижение выведения кальция с мочой: гипопаратиреоз, рахит, острый нефрит (нарушение фильтрации в почках), гипотериоз.
Содержание железа в сыворотке крови в норме ммоль/л.
Повышение содержание железа в сыворотке крови: апластическая и гемолитическая анемии, гемохроматоз, острый гепатит и стеатоз, цирроз печени, талассемия, повторные трансфузии.
Снижение содержания железа в сыворотке крови: железодефицитная анемия, острые и хронические инфекции, опухоли, заболевания почек, кровопотеря, беременность, нарушение всасывания железа в кишечнике.
Использованные источники:
