Механизмы адаптации при сердечной недостаточности
Механизмы адаптации при сердечной недостаточности
В последние годы поиск новых подходов к проблеме застойной сердечной недостаточности основывается на данных молекулярной генетики. В кардиомиоцитах больных с конечной стадией застойной сердечной недостаточности обнаружено увеличение количества генов АПФ и рецепторов ангиотензина II. Это обусловливает увеличение синтеза ДНК и белков, а также усиление клеточной пролиферации, т.е. приводит к ремоделированию миокарда.
В результате снижается общий кровоток, уменьшается приток крови к органам и тканям организма и в большинстве случаев сердце (или его отделы) не в состоянии перемещать то количество крови, которое к нему поступает. Перед пораженным отделом сердца возникают застойные явления, нарушается водноэлектролитный обмен.
Происходят вторичные изменения во многих органах и системах организма. Как застойные явления, так и вазоконстрикция, вызванные сердечной недостаточностью, существенно ухудшают функциональное состояние почек и печени. Нарушаются метаболическая и гормональная функции этих органов. Дисфункция почек и печени играет важную роль в общей симптоматике, клиническом течении и прогнозе у больных с сердечной недостаточностью, она снижает толерантность к лекарственным препаратам, применяемым для лечения этих больных.
Сердечная недостаточность может также влиять на функцию легких и регуляцию дыхания. Кроме того, происходят изменения в эндокринных органах и иммунной системе. В скелетных мышцах уменьшается общая масса мышечных волокон, возникают изменения, которые приводят к нарушению их структуры и метаболизма. Эти изменения, по-видимому, являются результатом появления уже на раннем этапе заболевания общей слабости, снижения тонуса скелетной мускулатуры, усиления рефлекторной мышечной реакции на физическую нагрузку.
Патогенез хронической сердечной недостаточности
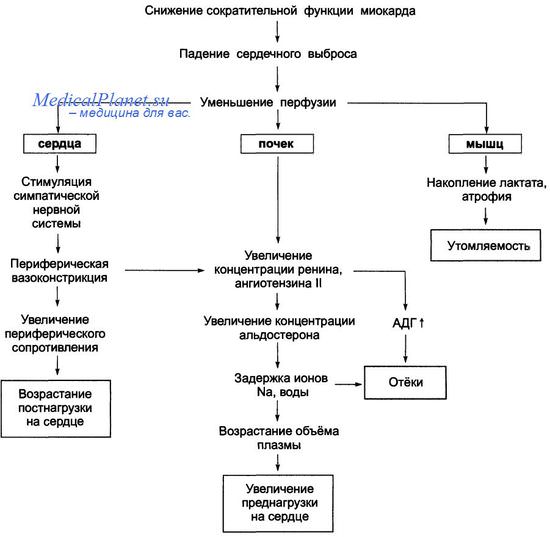
Возможно, эти явления способствуют развитию тахипноэ и чрезмерной вазоконстрикции. В периферических артериях, находящихся в состоянии хронической констрикции, возникают нарушения функции эндотелиальных клеток, обеспечивающих эндогенную вазодилатацию, увеличивается синтез мощного вазоконстриктора — эндотелина.
Застойные явления еще больше стимулируют активность нейрогормональных систем, замыкая порочный круг, усиливая задержку натрия и жидкости в организме, вызывая перегрузку малого, а затем и большого кругов кровообращения. Важно, что активация нейрогормонов играет одну из главных ролей в появлении сердечной недостаточности на всех этапах развития декомпенсации, от начала до исхода заболевания.
Таким образом, уже на ранних стадиях ХСН, обусловленных систолической дисфункцией левого желудочка, активизируются нейрогуморальные системы. Эти процессы, как указано выше, вначале имеют компенсаторноприспособительный характер. Затем, по мере прогрессирования заболевания, компенсаторные механизмы истощаются, а чрезмерная активность нейрогуморальных систем лишь усугубляет дисфункцию левого желудочка и усиливает сердечную декомпенсацию.
Ремоделирование сердца также представляет своеобразную адаптативную реакцию организма на изменяющиеся условия. У здоровых людей ремоделирование может появляться при длительных или кратковременных, но повторяющихся физических перегрузках (физиологическая гипертрофия). Оно может возникать и при различных заболеваниях и иметь характер компенсаторной или патологической гипертрофии миокарда.
Эти компенсаторные изменения в сердце происходят тогда, когда оно перестает справляться с функцией гидравлического насоса вследствие большой перегрузки либо объемом, либо давлением. Развитие желудочковой гипертрофии в ответ на сердечную недостаточность является одним из важных компенсаторных механизмов организма.
Использованные источники:
МЕХАНИЗМЫ КОМПЕНСАЦИИ ПРИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Механизмы компенсации при сердечной недостаточности делятся на две группы:
1. Интракардиальные (миокардиальные):
Срочные интракардиальные механизмы:
1) в ответ на кратковременную перегрузку объемом — гетерометрический механизм компенсации (закон Франка-Старлинга);
2) в ответ на кратковременную перегрузку давлением — гомеометрический механизм компенсации (феномен Анрепа);
3) рефлекс Бейнбриджа;
4) в ответ на острое повреждение и гибель части кардиомиоцитов — заместительный склероз (замещается только дефект структуры, функция не компенсируется).
Долговременные интракардиальные механизмы — это прогрессирующий процесс ремоделирования миокарда, зависящий от пускового фактора и представленный в виде компенсаторной гиперфункции сердца, в основе которой лежит гипертрофия миокарда.
Экстракардиальные механизмы компенсации при сердечной недостаточности:
I. Компенсаторная гиперактивация нейрогуморалъных систем, направленная на повышение работы сердца:
1) симпатоадреналовой системы (САС);
2) миокардиальной ренин-ангиотензиновой системы (РАС);
3) системы ренин-ангиотензин-альдостерон-АДГ (РААС-АДГ).
II. Компенсаторная гиперактивация дублирующих кислородтранспортных систем — эритропоэза и внешнего дыхания.
Проявления этой группы механизмов: вторичный эритроцитоз с повышением вязкости крови и повышением нагрузки на сердце; одышка.
Гетерометрический механизм (закон Франка-Старлинга) — это такой механизм компенсации, возникающий при перегрузке объемом, в основе которого лежит увеличение напряжения и силы сердечных сокращений в от-
вет на увеличение растяжения миокарда под влиянием избыточного объема крови.
Гомеометрический механизм (феномен Анрепа) — это такой механизм компенсации, возникающий при повышении сопротивления оттоку крови, в основе которого лежит постепенное повышение силы сердечных сокращений без значительного изменения длины мышечных волокон. В этом случае длина мышечного волокна практически не увеличивается (поэтому и механизм называется гомеометрическим), но повышается давление и напряжение, возникающее при сокращении мышц в конце диастолы. Повышение силы сердечных сокращений происходит не сразу, а постепенно, пока не достигнет уровня, необходимого для сохранения минутного объема крови. Этот механизм развивается при стенозах клапанов сердца, артериальной гипертензии и др. Из двух описанных механизмов наиболее полезен гетерометрический механизм, так как меньше потребляется кислорода, меньше расходуется энергии.
Рефлекс Бейнбриджа — это развитие тахикардии (увеличение частоты сердечных сокращений) вследствие повышения давления крови в полных венах, правом предсердии и растяжения их.
Использованные источники:
Сердечная недостаточность кровообращения. Механизмы компенсации
Сердечная недостаточность кровообращения развивается при несоответствии между предъявляемой сердцу нагрузкой и его способностью перекачивать всю кровь, поступившую по венам в артерии при определенном сопротивлении изгнанию крови в аорте и легочном стволе.
Существует три варианта недостаточности сердца:
- Недостаточность сердца от перегрузки развивается при увеличении сопротивления сердечному выбросу или усилении притока крови к определенному отделу сердца (т.е. рабочей перегрузкой сердца). Так, при пороках сердца (недостаточности клапанов или сужении отверстий в перегородке) изначально возникает нарушение внутрисердечной гемодинамики, а впоследствии развивается недостаточность кровообращения.
Недостаточность от перегрузки развивается также при гипертонии большого или малого круга; постоянная гиперфункция отмечается прежде всего у желудочка, работающего против повышенного сопротивления. Перегрузка может быть вызвана также чрезмерной физической работой, когда к сердцу предъявляются повышенные требования. Реже перегрузка развивается при заболеваниях системы крови или эндокринных заболеваниях (гипертиреоз).
- Недостаточность сердца при повреждении миокарда. Эти повреждения могут возникнуть вследствие инфекционного процесса, интоксикации, гипоксии, авитаминозов, нарушения коронарного кровообращения, утомления, при некоторых наследственных дефектах метаболизма. В этих случаях недостаточность сердца развивается при нормальной и даже сниженной нагрузке на него.
Некоронарогенные повреждения сердца – все повреждения, которые не связаны с патологией венечных сосудов ( гипоксический некроз миокарда, электролитно-стероидные кардиопатии, иммунные повреждения).
Коронарогенные повреждения сердца связаны с нарушением коронарного кровообращения (ишемическая болезнь сердца (ИБС) и инфаркт миокарда). ИБС – это нозологическая форма, которая объединяет группу заболеваний и патологических состояний , сопровождающихся нарушением кровоснабжения миокарда, причиной которого является поражение венечных артерий главным образом атеросклеротического характера.
Атеросклероз – это изменение стенки артерий, проявляющееся очаговым отложением жировых веществ в виде кашицеобразных масс (греч. Athere – каша), и соединительнотканным уплотнением (scleros – твердый).
Инфаркт миокарда – это очаговая ишемия и некроз мышцы сердца, возникающая вследствие прекращения притока крови или ее недостаточного поступления по одной из ветвей коронарных артерий. Наиболее частой причиной повреждения стенки артерий, как отмечалось ранее, является атеросклероз.
В патологии человека ИБС и инфаркт миокарда имеют наибольший удельный вес; смертность от этих заболеваний занимает первое место во всех развитых странах. По данным ВОЗ, факторами риска, предрасполагающими к возникновению ИБС и инфаркта миокарда, являются: генетическая предрасположенность, гипертоническая болезнь, сахарный диабет, малоподвижный и эмоционально напряженный образ жизни, избыточное питание с потреблением большого количества жиров, курение.
Кроме названных коронарогенных и некоронарогенных, выделяют еще нейрогенные поражения сердца. Они могут быть вызваны раздражением гипоталамуса, симпатического ствола, блуждающего нерва; поступлением в кровоток больших доз адреналина и адреналина.
Смешанная форма недостаточности сердца возникает при различном сочетании повреждения миокарда и его перегрузки (частный случай – ревматизм, сочетающий воспалительное (иммунное) повреждение миокарда и нарушение клапанного аппарата).
Недостаточность кровообращения может развиваться при нарушении притока крови к сердцу. Причины указанного явления: 1. малый объем крови, притекающей к сердцу по венам (постгеморрагическая гиповолемия, коллапс); 2. затруднение расширения полостей сердца во время диастолы и неспособность сердца принять всю притекающую кровь (тампонада сердца, которая возникает при скоплении жидкости в полости перикарда при перикардите, кровоизлияниях при ранении или разрыве сердца).
Механизмы компенсации при сердечной недостаточности
Любая форма поражения сердца с момента ее возникновения вызывает в организме включение компенсаторных процессов, направленных на предотвращение развития общей недостаточности кровообращения. Кроме общих внесердечных механизмов компенсации активизируются также и внутрисердечные компенсаторные механизмы:
- Тоногенная дилятация – расширение полостей сердца, сопровождающееся увеличением ударного объема. Закон Франка-Старлинга, устанавливающий прямую зависимость между уровнем заполнения кровью предсердий во время диастолы и величиной сердечного выброса имеет ограничение действия. Так, если степень растяжения мышечного волокна превышает 25 % от исходной длины, то сила сокращения сердца снижается. Поэтому тоногенная дилятация может обеспечить увеличение сердечного выброса и компенсацию сердечной недостаточности лишь временно.
- Тахикардия – учащение сердечных сокращений – временно поддерживает нормальный минутный объем кровотока, но связан с дополнительным расходованием кислорода и энергии, нагрузкой на сердце и в конечном счете усугубляет явления повреждения.
- Гипертрофия миокарда – увеличение массы сердца в основном за счет объема мышечных элементов. Различают физиологическую (рабочую) гипертрофию, когда масса сердца увеличивается пропорционально степени развития скелетной мускулатуры, и патологическую гипертрофию, когда увеличение массы сердца идет вне зависимости от развития скелетной мускулатуры. Но гипертрофия носит приспособительный характер то определенного предела по ряду причин: а) гипертрофия не распространяется на коронарные сосуды, нервные образования и проводящую систему сердца, поэтому гипертрофия сопровождается ухудшением условий питания и метаболизма кардиомиоцитов и нервной регуляции работы сердца. При этом длительная и интенсивная нагрузка приводит к дистрофическим изменениям сердечной мышцы, сопровождающимся расширением его полостей и снижением силы сокращений, т.е. возникает миогенная дилятация. Начинается декомпенсация .
В компенсаторной гиперфункции сердца выделяют 3 основные стадии:
- Аварийная стадия характеризуется сочетанием патологических изменений в миокарде с мобилизацией резервов миокарда и организма в целом.
- Стадия завершившейся гипертрофии и относительно устойчивой гиперфункции. Гипертрофированное сердце приспособилось к новым условиям нагрузки и в течение длительного времени компенсирует ее.
- Стадия постепенного истощения и прогрессирующего кардиосклероза. Нарастающее истощение компенсаторных резервов приводит к развитию недостаточности общего кровообращения.
Основные нарушения работы сердца выражаются в расстройствах основных функций сердца: возбудимости, проводимости и автоматии; связаны с органическими и функциональными поражениями миокарда. Клинические выражения указанных расстройств – аритмии и экстрасистолии.
Аритмии – изменения частоты, силы и последовательности сердечных циклов и отдельных их элементов.
а) дыхательная (респираторная) – характеризуется учащением сокращений сердца и пульса во время вдоха и замедлением во время выдоха. Не вызывает расстройства кровообращения, но указывает на повышенную возбудимость вагуса. Является нормой для молодых и мелких животных, а у лошадей – при эмфиземе легких.
б). Синусовая аритмия: не связана с фазами дыхания, проявляется неодинаковой продолжительностью интервалов между сокращениями сердца. Обусловлена нарушением тонуса вегетативной нервной системы, иннервирующей сердце; наблюдается при некоторых интоксикациях, а у рабочих лошадей – при неравномерной нагрузке.
- Интракардиальные аритмии, которые характеризуются выпадением одного сердечного сокращения и появлением пауз различной продолжительности, после которых следуют нормальные по силе и ритму сердечные сокращения. В основе интракардиальных аритмий лежит нарушение проведения импульсов по проводящей системе сердца – блокада. От локализации блокирования импульса в проводящей системе различают следующие виды блокад:
а). синоаурикулярная (между синусным узлом и предсердиями),
б). атриовентрикулярная (между предсердиями и желудочками, в атриовентрикулярном узле),
в). блокада ножек пучка Гиса (в правой или левой ножках пучка Гиса).
Блокады бывают частичные и полные. Частичные блокады могут быть органического происхождения (в результате повреждения проводящей системы сердца), а также неврогенной природы (в результате торможения импульсов). Частичные неврогенные блокады проявляются в покое паузами в пульсе и выпадениями тонов сердца; при возбуждении или физической нагрузке исчезают. Полные блокады характеризуются редкими паузами и обмороками. Возникает рассогласование в работе предсердий и желудочков, развивается нарушение гемодинамики с тяжелыми последствиями.
Экстрасистолия – это внеочередное (преждевременное) сокращение сердца вследствие появления дорбавочного импульса из гетеротропного очага возбуждения. Если в проводящей системе сердца имеется очаг парабиоза, то он парадоксально реагирует на импульсацию (слабый импульс может вызвать реакцию по типу оптимум или максимум), вследствие чего возникает преждевременное возбуждение и сокращение – систолу. В зависимости от места возникновения добавочного импульса различают предсердные, атриовентрикулярные и желудочковые экстрасистолы.
В механизме возникновения экстрасистолий особую роль играет нарушение нервной регуляции деятельности сердца и нарушение электролитного обмена в ткани миокарда.
В группе аритмий, возникающих вследствие нарушений возбудимости, находятся также мерцательная аритмия и пароксизмальная тахикардия.
Мерцательная аритмия – это мельчайшие фибриллярные сокращения отдельных мышечных элементов вместо нормального синусового возбуждения. Если фибрилляция распространяется только на предсердия, а желудочки сокращаются в нормальном ритме, говорят о мерцании предсердий. Они могут спонтанно прекратиться; условия для работы сердца сохраняются. Мерцание желудочков – это терминальное нарушение сердечной деятельности; не прекращается спонтанно и обычно приводит к остановке сердца. Указанное нарушение может быть устранено немедленным проведением комплекса мероприятий, направленных на прекращение фибрилляции желудочков – дефибрилляции сердца (использование разряда постоянного тока высокого напряжения – 4000 В в течение 0,1 с; электроды накладывают на грудь; позволяет синхронизировать сокращения отдельных мышечных элементов).
Мерцательная аритмия может возникать при закупорке венечных артерий, острой гипоксии, электротравме, тяжелых инфекциях и интоксикациях.
Пароксизмальная тахикардия – особый синдром, состоящий из внезапно начинающихся и круто обрывающихся приступов резкого учащения сердечных сокращений. Пульс при этом правильный. Приступы могут длиться минуты, часы и дни. Пароксизмальная тахикардия часто наблюдается при митральных пороках; у человека в момент приступа частота сокращений сердца составляет 140-250 ударов в 1 минуту. Механизм указанной патологии окончательно не выяснен.
Использованные источники:
