Хроническая сердечная недостаточность ресинхронизирующая лечение
Ресинхронизирующая терапия сердечной недостаточности
Ресинхронизирующая терапия
 Ресинхронизирующая терапия – это методика позволяющая усилить насосную функцию сердца, тем самым уменьшая проявления сердечной недостаточности. К сожалению, этот метод не является панацеей и подходит далеко не всем пациентам с сердечной недостаточностью.
Ресинхронизирующая терапия – это методика позволяющая усилить насосную функцию сердца, тем самым уменьшая проявления сердечной недостаточности. К сожалению, этот метод не является панацеей и подходит далеко не всем пациентам с сердечной недостаточностью.
Как вы знаете, сердечная недостаточность – это финал (и не очень желанный) любого сердечнососудистого заболевания, она развивается виду выпадения из работы значительной части клеток сердечной мышцы.
Конечно, иногда причина сердечной недостаточности кроется в пороках сердца и его неадекватном кровообращении, ввиду атеросклероза коронарных артерий. В таких случаях устранение конкретной причины (замена клапанов, АКШ или стентирование) может практически полностью избавить пациента от этой проблемы.
Но чаще всего сердце утрачивает свою насосную функцию ввиду постепенной длящейся годами гибели мышечных клеток и восстанавливать их до сих пор не научились.
Лечение сердечной недостаточности (одышки, отеков) у этой группы пациентов является очень трудной задачей, а прогноз всегда неблагоприятный. Но иногда есть более или менее радикальное лечение — ресинхронизирующая терапия.
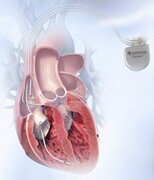
Принцип ресинхронизирующей терапии основан, исходя из названия, в искусственной синхронизации работы всех отделов сердца. Каким образом это достигается? Пациенту имплантируют кардиостимулятор (трехкамерный) один из его электродов стимулирует предсердия, второй — правый желудочек, третий – левый желудочек.
Если у пациента до имплантации кардиостимулятора были признаки нарушения координации работы сердца, то есть левый и правый желудочек сокращались не одновременно, то синхронизация способна значительно повысить общую насосную функцию сердца.
Но если на фоне сердечной недостаточности сердце и так работало синхронно, то толка от ресинхронизирующей терапии не будет и её использование может даже оказать значительный вред.
Как же определить, кому показано такое лечение, а кому нет?
Для того чтобы сказать, кому не показана или противопоказана ресинхронизирующая терапия, достаточно взглянуть на ЭКГ пациента – отсутствие признаков внутрижелудочковой блокады, в том числе блокады левой или правой ножек пучка Гиса, уже исключает возможность проведения такого лечения. Если же блокады присутствуют, вопрос решается индивидуально и надежда на облегчение симптомов сердечной недостаточности остается.
Подытожив все вышесказанное можно сказать, что ресинхронизирующая терапия – это метод лечения сердечной недостаточности который проводится посредством имплантации специального (трехкамерного электрокардиостимулятора). Такое лечение показано только тем пациентам, у которых имеются признаки нарушения синхронности сокращения правого и левого желудочков – основных насосных камер сердца, в других случаях такое лечение будет неэффективным и даже может нанести вред.
Журнал «Медицина неотложных состояний» 1(14) 2008
Вернуться к номеру
Ресинхронизирующая терапия сердца в кардиохирургической клинике
Авторы: И.В. Поливенок, Д.Е. Волков, Ю.Н. Скибо, О.В. Бучнева, А.В. Петков, А.Ю. Таранец, Н.В. Тищенко, Институт общей и неотложной хирургии АМН Украины, г. Харьков
Версия для печати
Во многих случаях сердечной недостаточности развиваются механическая асинергия желудочков и дисфункция внутрижелудочковых структур. Наиболее значимую роль в этом плане играют диссинхрония желудочков с блокадой левой ножки пучка Гиса и митральная регургитация. В статье рассматриваются механизмы действия ресинхронизирующей терапии сердца как одного из наиболее эффективных способов лечения сердечной недостаточности. Авторами предложен экономичный вариант ресинхронизации сердца с помощью эпикардиальной имплантации левожелудочкового электрода электрокардиостимулятора.
Сердечная недостаточность (СН) является одной из наиболее значимых проблем здравоохранения развитых стран, поражая до 2 % всего населения Европы [1]. В России в 2002 году было зарегистрировано 8,1 млн пациентов с СН, а каждый второй пациент кардиологического стационара находился там по поводу СН. С каждым годом распространенность СН неуклонно растет, что связано прежде всего с общим старением населения в развитых странах. И наконец, в отношении качества и продолжительности жизни пациентов СН является более злокачественным состоянием, чем рак, поскольку 5-летняя выживаемость пациентов с СН существенно ниже, чем при многих формах рака [1]. Все эти факты подчеркивают несомненную актуальность широкого внедрения в клинику новых подходов к лечению СН.
По определению Европейского общества кардиологов, под СН понимают состояние, при котором имеются симптомы недостаточности сердца в покое или при нагрузке плюс объективные (предпочтительнее эхокардиографические) доказательства кардиальной дисфункции в покое [1].
Основными причинами СН являются:
— дилатационная кардиомиопатия (включая алкогольную);
— врожденные дефекты сердца.
В основе патогенеза СН (рис. 1) лежит снижение функции левого желудочка (систолической или диастолической), которое вызывает нейрогуморальную адаптацию и в конечном счете дезадаптацию. Сегодня известно несколько основных классов медикаментозных средств, влияющих на этот нейрогуморальный дезадаптивный каскад. Это прежде всего препараты, блокирующие ренин-ангиотензин-альдостероновую систему и адренергическую активацию.

С другой стороны, во многих случаях СН развивается механическая асинергия желудочков и дисфункция внутрижелудочковых структур. Наиболее значимую роль в этом плане играют диссинхрония желудочков с блокадой левой ножки пучка Гиса (БЛНПГ) и митральная регургитация [2]. Способы коррекции асинергии и дисфункции желудочков относятся в основном к хирургии и интервенционной кардиологии. Повышенный интерес медицинской общественности к этому вопросу, возникший в последние годы, связан прежде всего с неожиданно высокой эффективностью данных методов лечения сердечной недостаточности, зачастую превышающей по клиническим последствиям эффективность оптимальной медикаментозной терапии, включая терапию диуретиками.
В настоящей публикации мы хотели бы акцентировать внимание на ресинхронизирующей терапии сердца как одном из наиболее эффективных способов лечения СН. Рассмотрение других хирургических методов коррекции функции желудочков требует отдельного изложения и выходит за рамки данной статьи.
Теоретической основой для ресинхронизирующей терапии являются следующие широко известные факты. СН является прогрессирующим состоянием, и механизмы, используемые сердцем для компенсации недостаточной насосной функции, могут со временем приводить к изменениям архитектоники сердца или ремоделированию. Во многих случаях такое ремоделирование вызывает межжелудочковую и внутрижелудочковую диссинхронию, то есть невозможность желудочков сокращаться в физиологических временных рамках. В клинике этот феномен проявляется нарушением проведения импульса внутри желудочка или по левой ножке пучка Гиса, соответственно возбуждение боковой стенки левого желудочка значительно запаздывает по отношению к перегородке, которая сокращается синхронно с правым желудочком. Гемодинамическими следствиями этого феномена являются снижение фракции изгнания, снижение времени диастолического наполнения желудочка, парадоксальные движения перегородки и митральная регургитация. Ресинхронизировать желудочки возможно путем имплантации электрода электрокардиостимулятора (ЭКС) в боковые отделы левого желудочка с целью устранения межжелудочковой задержки проведения импульса [3, 4].
Несколько хорошо организованных клинических испытаний способствовали прочному укреплению ресинхронизации сердца в клинике. Достаточно остановиться на двух из них, которые являются своего рода классическими. В исследовании CARE-HF было обнаружено достоверное снижение общей смертности на 36 % при ресинхронизации сердца по сравнению с медикаментозной терапией среди 813 пациентов с СН III–IV функциональных классов (ФК) [6]. Исследование COMPANION, включавшее 1520 пациентов с СН III–IV ФК, показало снижение смертности и госпитализаций по поводу СН на 34 %, а общей смертности — на 24 % среди ресинхронизированных пациентов в сравнении с оптимальной медикаментозной терапией [5].
Классическим вариантом ресинхронизирующей терапии сердца является бивентрикулярная электрокардиостимуляция с имплантацией левожелудочкового электрода в область боковой стенки ЛЖ через коронарный синус (рис. 2).

Однако данная методика имеет некоторые ограничения. Прежде всего это высокая стоимость устройства (до 6000 евро), необходимость высококачественной полипроекционной ангиографической системы и достаточного опыта. Кроме того, анатомически сложные варианты коронарного синуса могут потребовать многочасовых попыток имплантации левожелудочкового электрода со всеми вытекающими последствиями в виде избыточной лучевой нагрузки и передозировки контрастом. В условиях ограниченных материальных ресурсов, в которых длительно пребывает наша медицина, либо при возникновении сложностей с катетеризацией коронарного синуса мы считаем целесообразным использование методики эпикардиальной имплантации специального электрода через миниторакотомию. Предсердный же электрод имплантируется эндоваскулярно обычным способом. Оба электрода присоединяются к двухкамерному ЭКС. В этом случае возбуждение распространяется на правый желудочек по правой ножке пучка Гиса, а на левый — через ЭКС. Следующий клинический пример показывает эффективность нашей методики.
Пациентка З. 51 года, поступила с диагнозом «идиопатическая дилатационная кардиомиопатия», СН IIБ ст. NYHA III». ЭКГ — блокада ЛНПГ. ЭхоКГ: дилатация левых полостей сердца, фракция выброса (ФВ) — 31 %, время задержки сокращения задней стенки левого желудочка по отношению к перегородке (МЖП — ЗС ЛЖ) — 150 мс, время от зубца Q до начала изгнания в аорту (Q — Ао) — 190 мс.
Пациентке выполнена двухэтапная операция — эндокардиальная имплантация предсердного электрода в правое предсердие, а затем трансторакальная имплантация желудочкового электрода в переднебоковые отделы левого желудочка. Торакотомия проведена под общим наркозом севораном и закисью азота. Периоперационный период протекал без особенностей. Состояние при выписке значительно улучшилось, проявления СН уменьшились до NYHA I–II. Время задержки МЖП — ЗС ЛЖ снизилось до 70 мс, время Q — Ao до 110 мс, а ФВ увеличилась до 41 %.
Эту же методику можно с успехом применять во время операций на открытом сердце, когда с помощью ресинхронизации желудочков можно получить дополнительные преимущества в улучшении функции сердца. Нами применена интраоперационная ресинхронизация желудочков у двух пациентов с выраженной сердечной недостаточностью вследствие клапанных пороков сердца, фибрилляции предсердий и диссинхронии желудочков. В конце основного этапа протезирования клапана сердца обоим пациентам были имплантированы эпикардиальные электроды в боковую стенку ЛЖ и начата электростимуляция левого желудочка. В обоих случаях получен значительный прирост фракции изгнания ЛЖ — на 18 и 12 % соответственно. Причем при контрольном выключении ЭКС фракция изгнания снижалась, а после включения повышалась вновь.
У одного из пациентов был выявлен интересный феномен, описание которого ранее не встречалось нам в литературе. На 5-е сутки после операции и начала левожелудочковой стимуляции у пациента развились признаки правожелудочковой недостаточности вследствие выраженного запаздывания сокращений теперь уже правого желудочка. Ему был имплантирован дополнительный эндокардиальный электрод в правый желудочек и налажена бивентрикулярная стимуляция (рис. 3). Явления правожелудочковой дисфункции уменьшились.
Данный феномен мы объясняем тем, что у пациентов с диссинхронией желудочков и фибрилляцией предсердий нормальный предсердный импульс отсутствует. Поэтому при стимуляции левого желудочка импульс распространяется с боковой стенки левого желудочка на правый через ножки пучка Гиса с задержкой, особенно в случае блокады одной из ножек. В этом случае мы рекомендуем имплантацию электродов как в левый, так и в правый желудочек с целью достижения надежной ресинхронизации.
Таким образом, ресинхронизирующая терапия сердца является эффективным методом лечения сердечной недостаточности и должна шире использоваться в клинике. Существуют простые и экономичные методики ресинхронизирующей терапии сердца, которые вполне приемлемы в условиях ограниченных материальных ресурсов.
Использованные источники:
Сердечная ресинхронизирующая терапия

 К лечению ХСН — по тернистому пути
К лечению ХСН — по тернистому пути
На протяжении более тысячи лет такое тяжелое заболевание, как хроническая сердечная недостаточность (ХСН), лечили исключительно наперстянкой (digitа́lis). Первое упоминание о ней приведено в «Medigon midwai», изданном в Ирландии в XI веке. Известный немецкий клиницист Бернгард Наунин писал: «Я не хотел бы быть врачом, если бы не существовало дигиталиса», а великий терапевт, академик АМН СССР Борис Вотчал в своей последней книге «Сердечные гликозиды» (Москва, 1973 г.) отмечал, что «дигиталис — это «инсулин сердечных больных», …«костыль», на который опирается декомпенсированное сердце». Эти аксиомы медицины постигались многими поколениями врачей, но само лечение было искусством каждого из них, поскольку не хватало науки.
Поворотными событиями стали открытие в 1965 г. бразильским ученым-биологом С. Феррейра стабилизатора брадикинина, выделенного из яда гремучей змеи жарараки, и синтез в 1975 г. Д. Кушманом и М. Ондетти первого ингибитора ангиотензинпревращающего фермента (иАПФ) — каптоприла. Однако удачный опыт его использования у больных с ХСН подытожили лишь спустя многие годы.
Таким образом, революционная технология с величайшим трудом внедрялась в клиническую практику и впоследствии стала основой использования т. н. нейромодуляторов. К последним относят некоторые бета-адреноблокаторы, в т. ч. метопролола сукцинат, карведилол и бисопролол, малые дозы антагонистов альдостерона (АА) (в РБ есть только верошпирон) и дигоксина, а также торасемида (в РБ — диувера) и максимально переносимые дозы антагонистов (или блокаторов) рецепторов ангиотензина-2 I типа (АРА), например вальсартана, кандерсартана и — в большой дозе — лозартана. Их путь в клиническую практику тоже не прост. Так, удивительный по своей полезности опыт лечения очень тяжелых больных ХСН бета-адреноблокаторами (БАБ) шведским профессором Ф. Ваагштейном (Waagstein) опубликован еще в 1975 г., но официально его признали 24 года спустя.
В результате нового понимания патогенеза ХСН и, как следствие, бурного развития фармакологии сегодня разработаны национальные стандарты лечения данной категории пациентов. Это продлило жизнь многим больным во всем мире. Так, в странах Европейского сообщества, в США и Канаде средний возраст людей с ХСН превышает 77 лет.
Активно разрабатываются дорогостоящие, но очень перспективные направления (например, фармакогенетика), которые со временем позволят проводить не дифференцированную, а индивидуализированную терапию. Поскольку поиск новых методик и подытоживание имеющегося опыта в области молекулярной биологии (скажем, по сохранению защитников хромосом — теломер), генетики и генной инженерии не завершены, успешно применяются различные механические устройства, улучшающие качество жизни пациентов и, в ряде случаев, ее продолжительность. Это касается, в частности, использования сравнительно новой технологии — сердечной ресинхронизирующей терапии (СРТ), осуществляемой с помощью имплантации бивентрикулярных электрокардиостимуляторов (ЭКС).
Патофизиологическое обоснование целесообразности использования СРТ
По данным российских эпидемиологов, в 59% случаев причина ХСН — коронарная болезнь сердца (КБС). Острая и хроническая ишемии влияют на миокард левого желудочка (ЛЖ) по-разному. Первая, если не вызывает коронарную смерть, то приводит к появлению обширной зоны асинергии серд-ца, а в конечном счете — к ремоделированию миокарда и развитию сердечной недостаточности. Из-за хронической ишемии развивается диффузный кардиосклероз, что может завершиться ишемической кардиомиопатией и ХСН.
Глобальная сократимость мышцы сердца во многом зависит от синхронности сокращений ее отдельных участков. В норме оба
желудочка работают согласованно, с небольшой задержкой после сокращения предсердий. У 30% пациентов с клинически выраженной ХСН отмечаются не только существенное снижение сократимости миокарда, но и изменения в проводящей системе, что может проявляться в виде полной блокады левой ножки пучка Гиса. Следствие такой блокады — задержка начала систолы правого желудочка (ПЖ) и ЛЖ. Нарушение распространения возбуждения приводит к тому, что разные участки миокарда сокращаются в разное время, это увеличивает общее время данного процесса для мышц сердца и снижает эффективность самого сокращения.
Замедленное, «запаздывающее» возбуждение части миокарда и асинхронное сокращение различных его участков называется диссинхронией. Различают электрическую
и механическую. К первой относят неодинаковую скорость распространения возбуждения миокарда, ко второй — несинхронное сокращение его отдельных участков.
В зависимости от локализации выделяют предсердно-, меж- и внутрижелудочковую диссинхронии. Их значимость можно проиллюстрировать следующим образом. Если взять крайнюю форму проявления предсердно-желудочковой диссинхронии — атриовентрикулярную (АV) блокаду III степени, то у пациентов сокращение предсердий происходит не перед началом сокращения желудочков (как в норме), а совпадает с их ранним наполнением. Таким образом, теряется вклад в этот процесс предсердной систолы.
Особое внимание уделяется желудочковой диссинхронии, часто встречающейся у больных ХСН, крайнее проявление которой — полная блокада левой ножки пучка Гиса. При блокаде одной из ножек пучка Гиса волна возбуждения доходит до соответствующего желудочка с задержкой. В результате его сокращение происходит с опозданием, что также снижает силу сокращения сердечной мышцы.
Внутрижелудочковая механическая диссинхрония чаще встречается в ЛЖ при блокаде левой ножки пучка Гиса, когда возбуждение перегородки возникает быстро, а латеральной стенки ЛЖ — с опозданием, поскольку волна возбуждения идет не по ножке Гиса, а в обход по миокарду ЛЖ. Из-за того, что сокращение перегородки возникает раньше, чем боковой стенки ЛЖ, эффективность сокращения ЛЖ снижается, сердечный выброс падает. Установлено,
что чем больше масса миокарда и ниже фракция выброса (ФВ) ЛЖ, тем пагубнее влияние диссинхронии на сердечный выброс и судьбу пациента. Уместно отметить, что при нормальной ФВ наличие блокады левой ножки пучка Гиса существенно не влияет на клиническое течение ХСН, но, по данным экспертов Американской ассоциации кардиологов, выполнивших многоцентровое исследование VEST (1999), смертность больных с ХСН с QRS ЭКГ220 мс в 5 раз выше, чем у лиц с QRS90 мс.
Применение СРТ в клинической практике
В мире и у нас десятилетиями использовались ЭКС типа VVI, работающие в режиме однокамерной стимуляции ПЖ «по требованию», т. е. когда ЭКС включался лишь в ответ на выраженную ( 130 мс и
при установке ЭКС эффект достигался только у 60–67% больных. Сейчас накоплен опыт, свидетельствующий, что пациенты, имеющие нормальную ширину QRS, но с механической диссинхронией хорошо откликаются на СРТ. Это дало перспективу проведения дальнейших научных исследований.
Тем не менее в силу того, что СРТ — очень дорогой способ лечения и определение респондентов на сегодня не завершено, в большинстве стран данный метод используется у пациентов с ХСН III–IV ФК тяжести с ФВ ЛЖ Разработка:БЕЛТА
Использованные источники:
Хроническая сердечная недостаточность (ХСН): классификация, симптомы и лечение

Хроническая сердечная недостаточность (ХСН) характеризуется несоответствием между возможностями сердца и потребностью организма в кислороде. Вначале недостаточная функция сердца проявляется лишь при нагрузке, а затем и в покое. Хроническая сердечная недостаточность характеризуется комплексом характерных симптомов (одышка, снижение физической активности, отеки), часто сопровождается задержкой жидкости в организме.
Причина сердечной недостаточности – ухудшение способности сердца к наполнению или опорожнению. Оно обусловлено повреждением миокарда и дисбалансом регуляторных систем. В данной статье опишем симптомы, лечение хронической сердечной недостаточности, а также поговорим о классификации ХСН.
Классификация
В нашей стране была принята классификация ХСН по Н.Д. Стражеско и В.Х. Василенко. Она предполагает условное разделение ее на три стадии.
I стадия – начальная (латентная, скрытая). Неполноценность работы сердца проявляется лишь при нагрузке.
II стадия – нарушение гемодинамики проявляется и в покое. При стадии II А гемодинамика нарушена умеренно, страдает в основном или правый, или левый отделы сердца. При стадии II Б нарушено кровообращение в обоих кругах, отмечаются выраженные патологические изменения в работе сердца.
III стадия – терминальная (конечная). Тяжелая недостаточность кровообращения сопровождается выраженным изменением обмена веществ, поражением структуры внутренних органов и нарушением их функций.
В настоящее время принята классификация тяжести ХСН в соответствии с переносимостью нагрузок. Выделяют 4 функциональных класса (ФК) ХСН. При I ФК пациент хорошо переносит обычную физическую активность. Значительная физическая нагрузка может сопровождаться одышкой или утомляемостью. При ХСН II ФК обычная физическая активность умеренно ограничена, при III ФК отмечается значительное ограничение привычной активности из-за одышки и других симптомов. IV ФК сопровождается невозможностью выполнить физическую нагрузку без жалоб, симптомы появляются и в покое.
Функциональные классы ХСН могут изменяться в зависимости от лечения. Полной корреляции между функциональными классами и стадиями по Стражеско-Василенко нет.
Дополнительно выделяют систолическую и диастолическую ХСН (преимущественное нарушение сократимости или расслабления миокарда). Иногда выделяют право- и левожелудочковую недостаточность в зависимости от наиболее пораженного отдела сердца.
Симптомы
I стадия
Пациент предъявляет жалобы на быструю утомляемость, одышку, учащенное сердцебиение при выполнении физической нагрузки (подъем по лестнице, быстрая ходьба).
При осмотре можно увидеть акроцианоз (синюшность кистей, стоп). Часто появляются небольшие отеки (пастозность) лодыжек, голеней к вечеру.
При нагрузке отмечается быстрое учащение пульса. Можно отметить умеренное расширение границ сердца, приглушенность тонов, слабый систолический шум на верхушке. Картина при осмотре больного определяется основным заболеванием (гипертоническая болезнь, порок сердца и так далее).
II А стадия
Симптомы в покое выражены незначительно, усиливаются лишь при нагрузке. При патологии левых отделов сердца развивается левожелудочковая недостаточность, проявляющаяся нарушением гемодинамики в малом круге кровообращения. Она сопровождается жалобами на одышку при ходьбе, подъеме по лестнице. Могут появляться приступы удушья по ночам (сердечная астма), сухой кашель, иногда кровохарканье. Больной быстро утомляется при обычной физической нагрузке.
При осмотре можно увидеть бледность, акроцианоз. Отеков нет. Отмечается смещение левой границы сердца, часто нарушения сердечного ритма, глухие тоны. Печень не увеличена. В легких выслушиваются сухие хрипы, при выраженном застое – мелкопузырчатые хрипы.
При патологии правых отделов сердца появляются признаки застоя в большом круге кровообращения. Больной предъявляет жалобы на тяжесть и боль в правом подреберье. Появляется жажда, отеки, уменьшается диурез. Возникает чувство распирания живота, одышка при обычной физической активности.
При осмотре виден акроцианоз, набухание шейных вен, отеки ног, иногда асцит. Характерна тахикардия, часто нарушения сердечного ритма. Границы сердца расширены во все стороны. Печень увеличена, поверхность ее гладкая, край закругленный, болезненный при пальпации. Лечение значительно улучшает состояние больных.
II Б стадия
Характерны признаки недостаточности кровообращения по большому и малому кругу. Появляются жалобы на одышку при незначительной нагрузке и в покое. Характерно сердцебиение, перебои в работе сердца, отеки, боль в правом подреберье. Беспокоит сильная слабость, нарушается сон.
При осмотре определяются отеки, акроцианоз, во многих случаях – асцит. Появляется вынужденное положение больного – ортопноэ, при котором пациент не может лежать на спине.
Границы сердца расширены во все стороны, имеется тахикардия, экстрасистолия, ритм галопа. В легких определяется жесткое дыхание, сухие и влажные хрипы, в тяжелых случаях накапливается жидкость в плевральной полости. Печень увеличена, плотная, с гладкой поверхностью, заостренным краем.
III стадия
Дистрофическая стадия проявляется тяжелыми расстройствами гемодинамики, нарушениями обмена веществ. Необратимо нарушаются структура и функции внутренних органов.
Состояние больных тяжелое. Выражена одышка, отеки, асцит. Возникает гидроторакс – скопление жидкости в плевральной полости. Развиваются застойные явления в легких.
Лечение
Лечение ХСН преследует такие цели, как предотвращение развития симптомов (для бессимптомной стадии) или их устранение; улучшение качества жизни; уменьшение числа госпитализаций; улучшение прогноза.
Главные направления лечения ХСН:
- диета;
- рациональная физическая активность;
- психологическая реабилитация, обучение больных;
- медикаментозная терапия;
- электрофизиологические методы;
- хирургические и механические методы.
Диета
Рекомендуется ограничение поваренной соли. Чем более выражены симптомы, тем сильнее нужно ограничивать соль, вплоть до отказа от нее.
Жидкость рекомендуется ограничивать лишь при выраженных отеках. Обычно советуют пить от 1,5 до 2 литров жидкости в сутки.
Пища должна быть калорийной, с достаточным содержанием белка и витаминов.
Необходимо ежедневно следить за весом. Прирост массы тела более 2 кг за три дня свидетельствует о задержке жидкости в организме и угрозе декомпенсации ХСН.
Следить за весом нужно также для исключения развития кахексии.
Ограничение приема алкоголя носит характер общих рекомендаций, кроме больных с алкогольной кардиомиопатией. Следует ограничивать употребление большого объема жидкости, в частности, пива.
Режим физической активности
Физическая активность рекомендуется больным на любой стадии, находящимся в стабильном состоянии. Она противопоказана лишь при активном миокардите, стенозе клапанов сердца, тяжелых нарушениях ритма, частых приступах стенокардии.
Перед определением уровня нагрузки необходимо провести тест с 6-минутной ходьбой. Если пациент за 6 минут проходит менее 150 метров, начинать упражнения необходимо с дыхания. Можно надувать воздушный шар, плавательный круг несколько раз в день. После улучшения состояния присоединяются упражнения в положении сидя.
Если больной может пройти от 150 до 300 метров за 6 минут, показаны физические нагрузки в виде обычной ходьбы с постепенным удлинением дистанции до 20 км в неделю.
Если пациент может пройти более 300 метров за 6 минут, ему назначаются нагрузки в виде быстрой ходьбы до 40 минут в день.
Физическая активность значительно увеличивает переносимость нагрузки, улучшает эффективность лечения и прогноз. Эффект от таких тренировок сохраняется в течение 3 недель после их прекращения. Поэтому рациональные нагрузки должны стать частью жизни больного с ХСН.
Обучение больного
Пациент с ХСН должен иметь возможность получить всю необходимую ему информацию о его заболевании, образе жизни, лечении. Он должен иметь навыки самоконтроля за своим состоянием. Поэтому необходимо организовывать «школы» для таких пациентов и их родственников.
Немалую роль в повышении качества жизни такого больного имеет и медико-социальная работа, направленная на формирование здорового образа жизни, выбор режима физических нагрузок, трудовую занятость, адаптацию больного в обществе.
Медикаментозная терапия
Назначение лекарств при ХСН основано на принципах доказательной медицины.
Основные средства, эффект которых не вызывает сомнения:
Дополнительные средства, эффективность и безопасность которых требуют дальнейшего изучения:
 статины;
статины;- антикоагулянты (при мерцательной аритмии).
Вспомогательные препараты могут назначаться, исходя из клинической ситуации:
- периферические вазодилататоры (при сопутствующей стенокардии);
- блокаторы медленных кальциевых каналов (при упорной стенокардии и стойкой артериальной гипертензии);
- антиаритмические средства (при тяжелых желудочковых нарушениях ритма);
- аспирин (после инфаркта миокарда);
- негликозидные инотропные стимуляторы (при низком сердечном выбросе и гипотензии).
Электрофизиологические и хирургические методы
Применение электрофизиологических методов показано у больных с максимально активной, но недостаточно эффективной лекарственной терапией, которые могут сохранять высокое качество жизни. Основные методы:
- имплантация электрокардиостимулятора;
- сердечная ресинхронизирующая терапия (разновидность стимуляции сердца);
- постановка кардиовертера-дефибриллятора при тяжелых желудочковых нарушениях ритма сердца.
В тяжелых случаях ХСН может быть рассмотрен вопрос о трансплантации сердца, использовании аппаратов вспомогательного кровообращения (искусственные желудочки сердца), окутывании сердца специальным сетчатым каркасом для предотвращения его ремоделирования и прогрессирования сердечной недостаточности. Эффективность этих методов в настоящее время изучается.
Медицинская анимация на тему «Хроническая сердечная недостаточность»:
Использованные источники:
9. Хирургические и электрофизиологические методы лечения хсн
9.1. Электрофизиологические методы лечения хсн
сводятся на сегодняшний день к трем процедурам:
постановке (имплантации) обычных электрокардиостимуляторов (ЭКС), что актуально для пациентов с синдромом слабости синусового узла и атриовентрикулярными блокадами (см. рекомендации ВНОА по имплантации ЭКС, 2005) [352]. Кроме коррекции ритма сердца, это позволяет более эффективно и безопасно проводить медикаментозную терапию ХСН. При этом оптимальным является использование ЭКС не с фиксированной, а адаптируемой частотой стимуляции и прежде всего – двухкамерных.
Однако длительная стимуляция правого желудочка сама по себе является причиной асинхронии сокращения желудочков и чревата усугублением течения ХСН, поэтому предпочтительнее имплантировать желудочковый электрод с активной фиксацией в средние отделы межжелудочковой перегородки справа.
развитие этого направления привело к внедрению метода так называемой сердечной ресинхронизирующей терапии (СРТ). Для этого используется схема трехкамерной стимуляции сердца – один электрод в правом предсердии, второй в правом и третий (через коронарный синус) в ЛЖ. Такая система позволяет установить оптимальную для каждого больного атриовентрикулярную задержку (паузу между навязанным сокращением предсердий и желудочков) и устранить асинхронию в работе желудочков (путем их одновременной стимуляции).
наконец последней является постановка имплантируемого кардиовертера–дефибриллятора (ИКД) больным с ХСН и опасными для жизни желудочковыми нарушениями ритма сердца – желудочковой тахикардией или фибрилляцией желудочков сердца.
Следует отметить, что применение всех электрофизиологических методов лечения ХСН должно начинаться только на фоне максимальной активной терапии при ее недостаточной эффективности. Это не альтернатива, а дополнение к максимально активной терапии больных. Имплантация устройств СРТ и ИКД рекомендуются больным, которые не только находятся на оптимальной медикаментозной терапии по поводу СН, но и могут иметь достаточно высокий уровень качества жизни и ее продолжительность не менее одного года после имплантации устройства.
Современные принципы электрофизиологического лечения ХСН включают в себя положения, как правило подтвержденные крупными контролируемыми исследованиями и имеют высокую степень доказанности.
Сердечная ресинхронизирующая терапия (СРТ) (предсердно– двухжелудочковая стимуляция) показана больным с ХСН III–IV ФК, желудочковой диссинхронией (QRS≥120 мс и по данным ЭхоКГ) и сниженной ФВ ЛЖ, которые не могут быть компенсированы на максимальной медикаментозной терапии. Применение СРТ позволяет улучшать симптоматику больных (класс показаний I, степень доказанности А), снижать число госпитализаций (класс показаний I, степень доказанности А) и снижать смертность (класс показаний I, степень доказанности В)[1, 2, 353–355]
Имплантация ИКД с возможностью сердечной ресинхронизирующей терапии (СРТ) показана больным с ХСН III–IV ФК, сниженной ФВ ЛЖ и желудочковой диссинхронией (QRS≥120 мс и по данным ЭхоКГ), для улучшения течения заболевания и снижения смертности (класс показаний IIа, степень доказанности В) [1, 2, 353, 354].
Больным с умеренно выраженной ХСН (II ФК), применение сердечной ресинхронизирующей терапии может быть показано при наличии желудочковой диссинхронии, причем при наличии показаний для ИКД, рекомендуется имплантация ИКД с возможностью сердечной ресинхронизирующей терапии (класс показаний II а, степень доказанности С) [356].
Имплантация ИКД рекомендуется для улучшения прогноза всем больным, имевшим эпизод остановки сердца или ЖТ (вторичная профилактика ВСС) при наличии сниженной ФВ ЛЖ (менее 40 %) (класс показаний I, степень доказанности А) [352, 353, 356–358].
Имплантация ИКД рекомендуется больным с целью первичной профилактики ВСС при ишемической систолической дисфункции ЛЖ, после перенесенного не менее 40 дней назад ИМ, ФВ ЛЖ менее или равной 30–40 %, ФК II или III (класс показаний I, степень доказанности А), а также неишемической систолической дисфункцией ЛЖ и ФВ ЛЖ менее или равной 30–35 %, ФК II или III (класс показаний I, степень доказанности В) [1, 2, 353–357, 359–360].
Постановка ИКД не показана пациентам с рефрактерной ХСН, у которых невозможно предполагать достижение компенсации и благоприятного прогноза (класс показаний III, степень доказанности А) [1, 2, 352, 353].
Имплантация ИКД может быть рекомендована больным с ишемической дисфункцией ЛЖ (не менее чем через 40 дней после перенесенного ИМ), с ФВ ЛЖ менее или равной 30–35 %, находящихся в I ФК (класс показаний IIа, степень доказанности В) [1, 2, 352, 353, 356, 357, 360, 361].
Изолированная имплантация ИКД имеет ограничения, связанные как со стимуляцией правого желудочка, так и с разрядами, как обоснованными, так и необоснованными. Причем в обоих случаях происходит ухудшение течения ХСН. Для устранения диссинхронии вследствие желудочковой стимуляции, необходимо использовать устройство, сочетающее функции ИКД и ресинхронизации сердца. Для минимизации количества разрядов необходимо назначение адекватной медикаментозной антиаритмической терапии (амиодарон, соталол, бетаадреноблокаторы или их комбинация) и программирор вание ИКД в режиме, так называемой «безболевой терапии » путем использования на первом этапе купирования желудочковых аритмий (до нанесения шокового разряда ИКД) метода антитахикардитической стимуляции (класс показаний I, уровень доказанности С) [2, 360, 362].
Использованные источники:
